
Introdução
A Covid-19 (Coronavirus disease 2019) é uma doença causada pelo novo coronavírus (SARS-CoV-2), que teve origem na cidade de Wuhan, China, em novembro de 2019 1. Foi considerada, em janeiro de 2020, Emergência de Saúde Pública de Importância Internacional, e seu caráter pandêmico declarado em março de 2020 2.
A Covid-19 é uma síndrome respiratória aguda. A infecção por SARS-CoV-2 se dá após o contato do indivíduo com partículas virais eliminadas por meio de gotículas de saliva (fala, tosse, espirro) e/ou secreções respiratórias 3. O novo coronavírus tem tropismo por células epiteliais, e, após o contato do vírus com a mucosa do trato respiratório superior, a glicoproteína do envelope viral, spike ou proteína S, faz o reconhecimento e a ligação com o receptor de membrana específico da célula-alvo, conhecido como enzima conversora da angiotensina 2 (ECA-2) 4. Essa etapa de reconhecimento e ligação do vírus na célula é chamada de adesão viral e é crucial para determinar que hospedeiros ele será capaz de infectar. Após essa etapa, dá-se a penetração do vírus na célula por meio de endocitose e, em seguida, o desnudamento. No desnudamento viral, há liberação do material genético do vírus no citoplasma da célula, além de proteínas importantes para a replicação do seu genoma e a construção de novas partículas virais 5.
Até a primeira semana de 2021, foram registrados 87 milhões casos e cerca de 1,9 milhões de mortes no mundo pela Covid-19 6. No Brasil, esses números chegaram a aproximadamente 8 milhões de casos e mais de 200 mil mortes.
Em fevereiro de 2020, a Organização Mundial da Saúde (OMS) criou um grupo de experts ad hoc focados na modelagem da Covid-19 (COM), conhecido como WHO-COM, para acelerar o desenvolvimento de vacinas e agentes terapêuticos 7.
A produção de vacinas contra o SARS-CoV-2 tem sido fundamentada em seis tipos de biotecnologia, de acordo com seu alvo: vacinas com a proteína S (vacinas de RNA; vacinas de DNA; vacinas de proteínas recombinantes; e vacinas de vetor viral) ou com a partícula viral total (vacinas vivas atenuadas e vacinas inativadas) 8.
Estudos com modelos animais têm sido essenciais para avaliar o comportamento do SARS-CoV-2 e a patogenia da Covid-19 e para a produção de produtos terapêuticos e vacinas.
Desenvolvimento de vacinas
O desenvolvimento de uma vacina é algo complexo e com muitos obstáculos, que demanda alto investimento e pode levar anos até atingir o objetivo final, que é uma vacina segura, com poucos efeitos colaterais e de alta eficácia. A situação atual fez com que pesquisadores do mundo todo se empenhassem no desenvolvimento de um único fármaco, acelerando esse processo. Para ser comercializada, é necessário que a OMS e a agência sanitária do país que vai utilizá-la – a Anvisa, no caso do Brasil – aprovem a vacina após a última fase de testes clínicos em seres humanos 9. A vacina a ser comercializada passa por testes longos e rigorosos para assegurar que não apresentará manifestações de enhancement, isto é, provocar ou agravar a doença 9. O processo de desenvolvimento de uma vacina compreende três etapas 10 e está ilustrado na figura 1.
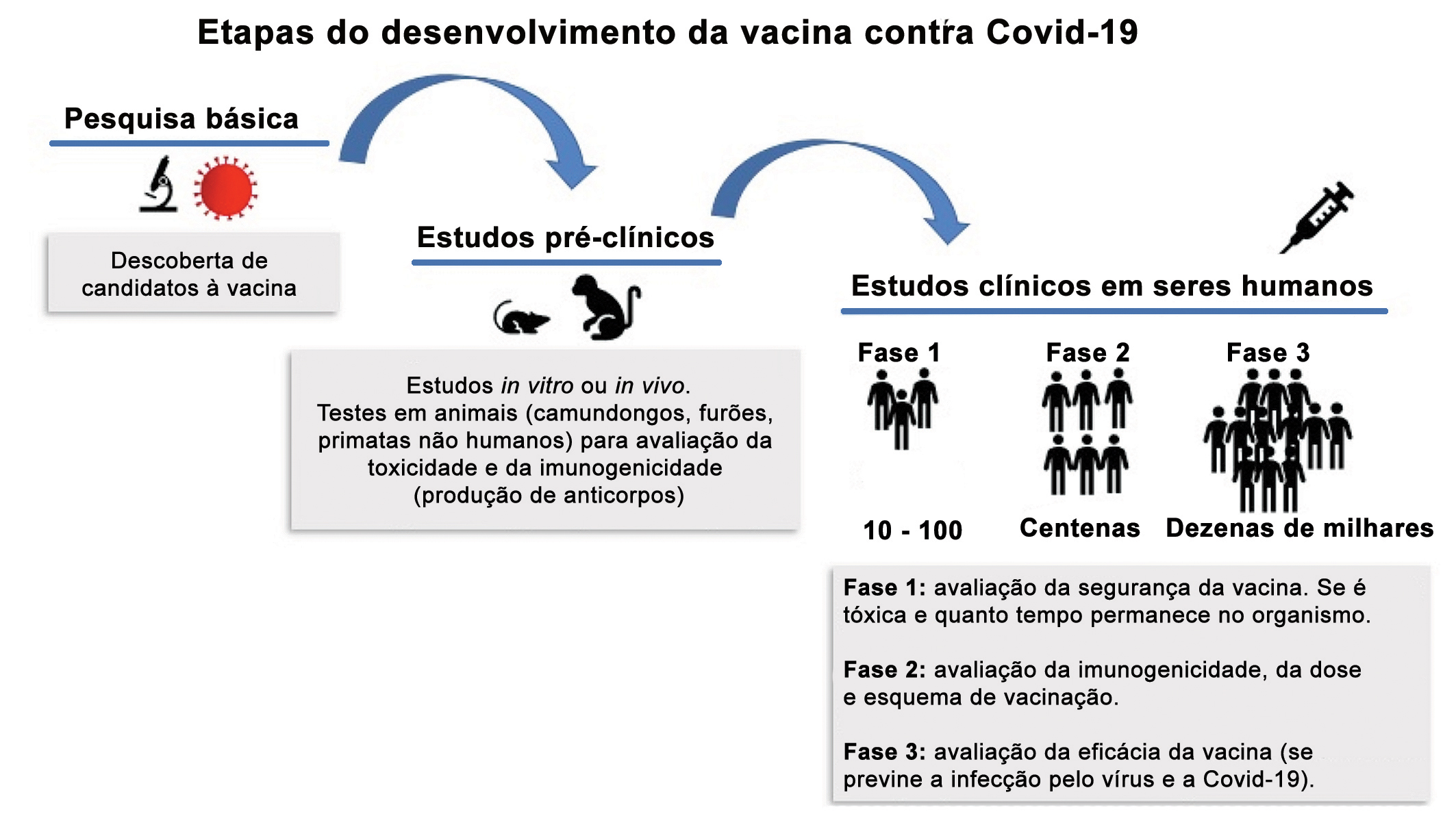
Modelos animais e de vacinas contra o SARS-CoV-2
O comportamento e os mecanismos fisiopatogênicos do SARS-CoV-2 têm sido amplamente investigados para o conhecimento da Covid-19 em macacos, hamsters, camundongos, coelhos e ferrets 11. Esses animais também têm sido avaliados para a produção de vacinas 7,12-18.
Nas primeiras investigações, uma das principais limitações no uso de modelos animais foi a falta de receptores celulares específicos para o SARS-CoV-2 que possam dar início à infecção viral, como o receptor ECA-2.
Um exemplo é o camundongo (Mus musculus), um dos animais mais utilizados em estudos experimentais. Embora esses animais não tenham receptores para a proteína S do SARS-CoV-2, os pesquisadores modificaram essa proteína para que ela se ligasse aos receptores celulares dos camundongos ou utilizaram modelos transgênicos que expressam o ECA-2 humano 7.
Por outro lado, alguns animais, como o hamster-sírio ou hamster-dourado (Mesocricetus auratus), têm sido considerados bons modelos para o estudo de vacinas, em virtude da alta similaridade do receptor ECA-2 com o humano (25 de 29 aminoácidos na região de ligação do vírus), da patogênese da doença e da transmissão para outros hamsters 19.
O furão (Mustela putorius furo) é outro modelo animal empregado nos estudos sobre a patogenia de vírus respiratórios, incluindo o SARS-CoV-2. Um estudo mostrou que uma dose de vacina de vetor adenoviral (Ad5-nCoV) induziu proteção contra SARS-CoV-2em camundongos Balb/c e em furões 20.
O macaco-rhesus (Macaca mulatta) tem sido o modelo de primata não humano mais empregado na avaliação experimental de vacinas. Esses animais mostraram capacidade de produzir anticorpos protetores após o desafio com vacinas de DNA 18, de RNA 21, de vetor adenoviral ChAdOx1 ncov-19 22 e proteína recombinante 17, como exemplos.
Entretanto, alguns países que vêm desenvolvendo a vacina contra a Covid-19 estão lidando com uma inflação nos custos de animais de laboratório e até mesmo com a escassez de alguns modelos experimentais para realizarem os testes pré-clínicos. Devido à alta demanda de macacos-rhesus para a realização dos testes, os laboratórios estão tendo que adiar as pesquisas ou buscar outras alternativas para a realização dos testes 23.
Outros animais, como galinhas, patos e suínos, têm sido avaliados como modelos experimentais para os testes de Covid-19, mas não existe replicação viral 7. Já o uso de peixe-zebra (ou paulistinha) tem sido promissor como alternativa para estudos sobre a Covid-19, pois a espécie tem a capacidade de expressar o receptor ECA-2 e, consequentemente, a produção de anticorpos 24,25. Os testes experimentais com peixe-zebra têm mostrado ser uma alternativa de menor custo e com respostas mais rápidas e mais próximas às do ser humano 26,27.
Em condições normais, o desenvolvimento de uma vacina para seres humanos pode levar de 15 a 20 anos – desde a descoberta de moléculas candidatas a vacinas, o desafio em modelos animais e as fases clínicas em seres humanos (I- segurança; II e III- proteção) 19. Com a urgência da produção de uma vacina contra a Covid-19, a Organização Mundial da Saúde (OMS) e a Food and Drug Administration (FDA) aprovaram o início dos testes clínicos em seres humanos, dispensando os testes de segurança em modelos animais.
Em 1959, dois pesquisadores criaram o princípio dos 3Rs da experimentação animal, com o objetivo de desenvolver uma pesquisa humanitária para os animais, tornando-se base para a ciência de qualidade. Os 3Rs significam: substituir (do inglês replace) os animais sencientes por alternativas in vitro ou microrganismos; reduzir o número de animais usados sem prejudicar a confiabilidade dos resultados; e refinar, ou seja, diminuir a incidência ou a severidade de procedimentos aplicados. Além disso, o posicionamento crítico de vários setores da sociedade civil, bem como de parte da comunidade científica, pressiona ainda mais os pesquisadores a buscarem alternativas que substituam os modelos in vivo 28.
Muitos estudos in vitro em linhagens celulares ou cultivo de células, ou ainda biotecnologias mais recentes, como organoides pulmonares, têm apresentado boas alternativas para substituir o uso de modelos animais em estudos de viroses respiratórias 7.
Considerações finais
O uso de animais de laboratório para experimentos científicos vem cada vez mais se aprimorando em busca de novas alternativas. O princípio dos 3Rs da experimentação animal já teve grandes avanços com o uso de células in vitro ou microrganismos; no entanto, em algumas pesquisas, os modelos in vivo são insubstituíveis para beneficiar a saúde pública. Na corrida para o desenvolvimento de uma vacina contra a Covid-19, os animais de laboratório se tornam imprescindíveis para auxiliar a controlar o avanço da pandemia.
Referências
01-WORLD HEALTH ORGANIZATION. Report of the WHO-China joint mission on Coronavirus Disease 2019 (COVID-19). WHO, 2020. Disponível em: <https://www.who.int/publications/i/item/report-of-the-who-china-joint-mission-on-coronavirus-disease-2019-(covid-19)>. Acesso em 2 de fevereiro de 2021.
02-WORLD HEALTH ORGANIZATION. Advice on the use of masks the community, during home care and in health care settings in the context of the novel coronavirus (2019-nCoV) outbreak: interim guidance, 29 January 2020. WHO, 2020. Disponível em: <https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance>. Acesso em 2 de fevereiro de 2021.
03-BRITO, S. B. P. ; BRAGA, I. O. ; MORAES, M. M. ; CUNHA, C. C. ; LEÃO, S. C. ; TAKEMANI, I. Mecanismos imunopatológicos envolvidos na infecção por SARS-CoV-2. Jornal Brasileiro de Patologia e Medicina Laboratorial, v. 56, n. e3352020, p. 1-10, 2020. doi: 10.5935/1676-2444.20200056.
04-WALLS, A. C. ; PARK, Y. J. ; TORTORICI, M. A. ; WALL, A. ; McGUIRE, A. T. ; VEESLER, D. Structure, function, and antigenicity of the SARS-CoV-2 spike glycoprotein. Cell, v. 181, n. 2, p. 281-292, 2020. doi: 10.1016/j.cell.2020.02.058.
05-ALMEIDA, J. O. ; OLIVEIRA, V. R. T. ; AVELAR, J. L. S. ; MOITA, B. S. ; LIMA, L. M. COVID-19: fisiopatologia e alvos para intervenção terapêutica. Revista Virtual de Química, v. 12, n. 6, p. 1-34, 2020. ISSN: 1984-6835. Disponível em: <http://static.sites.sbq.org.br/rvq.sbq.org.br/pdf/RVq170920-a4.pdf>. Acesso em 2 de fevereiro de 2021.
06-WORLD HEALTH ORGANIZATION. WHO Coronavirus Disease (COVID-19) dashboard. WHO, 2021. Disponível em: <https://covid19.who.int/>. Acesso em 2 de fevereiro de 2021.
07-MUÑOZ-FONTELA, C. ; DOWNLING, W. E. FUNNELL, S. G. P. ; GSELL, P. S. ; RIVEROS-BALTA, A. X. ; ALBRECHT, R. A. ; ANDERSEN, H. ; BARIC, R. S. ; CARROLL, M. W. ; CAVALERI, M. ; QIN, C. ; CROZIER, I. ; DALLMEIER, K. ; WALL, L. ; WIT, E. ; DELANG, L. ; DOHM, E. ; DUPREX, W. P. FALZARANO, D. ; FINCH, C. L. ; FRIEMAN, M. B. ; GRAHAM, B. S. ; GRALINSKI, L. E. GUILFOYLE, K. ; HAAGMANS, B. L. ; HAMILTON, G. A. ; HARTMAN, A. ; HERFST, S. ; KAPTEIN, S. ; KLIMSTRA, W. B. KNEZEVIC, I. ; KRAUSE, P. R. ; KUHN, J. H. LE GRAND, R. ; LEWIS, M. G. ; LIU, W. C. MAISONNASSE, P. ; McELROY, A. K. MUNSTER, V. ; ORESHKOVA, N. ; RASMUSSEN, A. L. ; PEREIRA, J. R. ; ROCKX, B. ; RODRIGUEZ, E. ; ROGERS, T. F. ; SALGUERO, F. J. ; SCHOTSAERT, M. ; STITTELAAR, K. ; THIBAUT, H. J. ; TSENG, C. T. ; ALERT, J. V. ; BEER, M. ; BRASEL, T. CHAN, J. F. W. ; SASTRE, A. G. ; NEYTS, J. ; PERLMAN, S. ; REED, D. S. ; RICHT, J. A. ; ROY, C. J. ; SEGALÉS, J. ; VASAN, S. S. ; RESTREPO, A. M. H. ; BAROUCH, D. H. Animal models for COVID-19. Nature, v. 586, n. 7830, p. 509-515, 2020. doi: 10.1038/s41586-020-2787-6.
08-AMANAT, F. ; KRAMMER, F. SARS-CoV-2 vaccines: status report. Immunity, v. 52, n. 4, p. 583-589, 2020. doi: 10.1016/j.immuni.2020.03.007.
09-GUIMARÃES, R. Anti-Covid vaccines: a look from the collective health. Ciência & Saúde Coletiva, v. 25, n. 9, p. 3579-3585, 2020. doi: 10.1590/1413-81232020259.24542020.
10-BRASIL. MINISTÉRIO DA SAÚDE. Monitoramento de vacinas em desenvolvimento contra SARS-Cov-2. Relatório técnico. Brasília: Ministério da Saúde, 2020. Disponível em: <https://www.gov.br/saude/pt-br/media/pdf/2020/novembro/13/20201030_cgpclin_decit_sctie_ms_relatorio_tecnico_monitoramento_vacinas_sars-cov-2_final.pdf>. Acessado em 27 de janeiro de 2020.
11-DHAMA, K. ; SHARUN, K. ; TIWARI, R. DADAR, M. ; MALIK, Y. S. ; SINGH, K. P. CHAICUMPA, W. COVID-19, an emerging coronavirus infection: Advances and prospects in designing and developing vaccines, immunotherapeutics, and therapeutics. Human Vaccines & Immunotherapeutics, v. 16, n. 6, p. 1232-1238, 2020, doi: 10.1080/21645515.2020.1735227.
12-DINNON, K. H. ; LEIST, S. R. ; SCHÄFER, A. ; EDWARDS, C. E. ; MARTINEZ, D. R. MONTGOMERY, S. A. ; WEST, A. ; YOUNT Jr., B. L. ; HOU, Y. J. ; ADAMS, L. E. ; GULLY, K. L. ; BROWN, A. J. ; HUANG, E. ; BRYANT, M. D. ; CHOONG, I. C. ; GLENN, J. S. ; GRALINSKI, L. E. ; SHEAHAN, T. P. BARIC, R. S. A mouse-adapted model of SARS-CoV-2 to test COVID-19 countermeasures. Nature, v. 586, n. 7830, p. 560-566, 2020. doi: 10.1038/s41586-020-2708-8.
13-ERASMUS, J. H. ; KHANDHAR, A. P. ; WALLS, A. C. ; HEMANN, E. A. ; O’CONNOR, M. A. ; MURAPA, P. ; ARCHER, J. ; LEVENTHAL, S. ; FULLER, J. ; LEWIS, T. DRAVES, K. E. ; RANDALL, S. ; GUERRIERO, K. A. ; DUTHIE, M. S. ; CARTER, D. REED, S. R. ; HAWMAN, D. W. ; FELDMANN, H. ; GALE Jr., M. ; VEESLER, D. ; BERGLUND, P. ; FULLER, D. H. Single-dose replicating RNA vaccine induces neutralizing antibodies against SARS-CoV-2 in nonhuman primates. bioRxiv, n. 05.28.121640, 2020. doi: 10.1101/2020.05.28.121640.
14-GAO, Q. ; BAO, L. ; MAO, H. ; WANG, L. ; XU, K. ; YANG, M. ; LI, Y. ; ZHU, L. ; WANG, N. ; LV, Z. ; GAO, H. ; GE, X. ; KAN, B. ; HU, Y. ; LIU, J. ; CAI, F. ; JIANG, D. ; YIN, Y. ; QIN, C. ; LI, J. ; GONG, X. ; LOU, X. ; SHI, W. ; WU, D. ; ZHANG, H. ; ZHU, L. ; DENG, W. ; LI, Y. ; LU, J. ; LI, C. ; WANG, X. ; YIN, W. ; ZHANG, Y. ; QIN, C. Development of an inactivated vaccine candidate for SARS-CoV-2. Science, v. 369, n. 6499, p. 77-81, 2020. doi: 10.1126/science.abc1932.
15-SUN, J. ; ZHUANG, Z. ; ZHENG, J. ; LI, K. ; WONG, R. L. Y. ; LIU, D. ; HUANG, J. ; HE, J. ; ZHU, A. ; ZHAO, J. ; LI, X. ; XI, Y. CHEN, R. ; ALSHUKAIRI, A. N. ; CHEN, Z. ZHANG, Z. ; CHEN, C. ; HUANG, X. ; LI, F. ; LAI, X. ; CHEN, D. ; WEN, L. ; ZHUO, J. ; ZHANG, Y. ; WANG, Y. ; HUANG, S. DAI, J. ; SHI, Y. ; ZHENG, K. ; LEIDINGER, M. R. ; CHEN, J. ; LI, Y. ; ZHONG, N. MEYERHOLZ, D. K. ; McCRAY Jr., P. B. ; PERLMAN, S. ; ZHAO, J. Generation of a broadly useful model for COVID-19 pathogenesis, vaccination, and treatment. Cell, v. 182, n. 3, p. 734-743, 2020. doi: 10.1016/j.cell.2020.06.010.
16-TAKAYAMA, K. In vitro and animal models for SARS-CoV-2 research. Trends in Pharmacological Sciences, v. 41, n. 8, p. 513-517, 2020. doi: 10.1016/j.tips.2020.05.005.
17-YANG, J. ; WANG, W. ; CHEN, Z. ; LU, S. ; YANG, F. ; BI, Z. ; BAO, L. ; MO, F. ; LI, X. ; HUANG, Y. ; HONG, W. ; YANG, Y. ; ZHAO, Y. ; YE, F. ; LIN, S. ; DENG, W. ; CHEN, H. LEI, H. ; ZHANG, Z. ; LUO, M. ; GAO, H. ; ZHENG, Y. ; GONG, Y. ; JIANG, X. ; XU, Y. LV, Q. ; LI, D. ; WANG, M. ; LI, F. ; WANG, S. ; WANG, G. ; YU, P. ; QU, Y. ; YANG, L. DENG, H. ; TONG, A. ; LI, J. ; WANG, Z. ; YANG, J. ; SHEN, G. ; ZHAO, Z. LI, Y. ; LUO, J. ; LIU, H. ; YU, W. ; YANG, M. XU, J. WANG, J. ; LI, H. ; WANG, H. KUANG, D. ; LIN, P. ; HU, Z. ; GUO, W. ; CHENG, W. HE, Y. ; SONG, X. ; CHEN, C. ; XUE, Z. YAO, S. ; CHEN, L. ; MA, X. ; CHEN, S. GOU, M. ; HUANG, W. ; WANG, Y. ; FAN, C. ; TIAN, Z. ; SHI, M. ; WANG, F. S. ; DAI, L. ; WU, M. ; LI, G. ; WANG, G. ; PENG, Y. ; QIAN, Z. ; HUANG, C. ; LAU, J. Y. ; YANG, Z. ; WEI, Y. ; CEN, X. ; PENG, X. QIN, C. ; ZHANG, K. ; LU, G. ; WEI, X. A vaccine targeting the RBD of the S protein of SARS-CoV-2 induces protective immunity. Nature, v. 586, n. 7830, p. 572-577, 2020. doi: 10.1038/s41586-020-2599-8.
18-YU, J. ; TOSTANOSKI, L. H. ; PETER, L. ; MERCADO, N. B. ; McMAHAN, K. ; MAHROKHIAN, S. H. ; NKOLOLA, J. P. ; LIU, J. ; LI, Z. ; CHANDRASHEKAR, A. ; MARTINEZ, D. R. ; LOOS, C. ; ATYEO, C. FISCHINGER, S. ; BURKE, J. S. ; SLEIN, M. D. ; CHEN, Y. ; ZUIANI, A. ; LELIS, F. J. N. ; TRAVERS, M. ; HABIBI, S. ; PESSAINT, L. VAN, R. Y. A. ; BLADE, K. ; BROWN, R. COOK, A. ; FINNEYFROCK, B. ; DODSON, A. ; TEOW, E. ; VELASCO, J. ; ZAHN, R. ; WEGMANN, F. ; BONDZIE, E. A. ; DAGOTTO, G. ; GEBRE, M. S. ; HE, X. ; JACOB-DOLAN, C. ; KIRILOVA, M. ; KORDANA, N. LIN, Z. ; MAXFIELD, L. F. ; NAMPANYA, F. ; NITYANANDAM, R. ; VENTURA, J. D. ; WAN, H. ; CAI, Y. ; CHEN, B. ; SCHMIDT, A. G. ; WESEMANN, D. R. ; BARIC, R. S. ; ALTER, G. ; ANDERSEN, H. ; LEWIS, M. G. BAROUCH, D. H. DNA vaccine protection against SARS-CoV-2 in rhesus macaques. Science, v. 369, n. 6505, p. 806-811, 2020. doi: 10.1126/science.abc6284.
19-DEB, B. ; SHAH, H. ; GOEL, S. Current global vaccine and drug efforts against COVID-19: pros and cons of bypassing animal trials. Journal of Biosciences, v. 45, n. 1, p. 82, 2020. doi: 10.1007/s12038-020-00053-2.
20-WU, S. ; ZHONG, G. ; ZHANG, J. ; SHUAI, L. ; ZHANG, Z. ; WEN, Z. ; WANG, B. ; ZHAO, Z. ; SONG, X. ; CHEN, Y. ; LIU, R. ; FU, L. ZHANG, J. ; GUO, Q. ; WANG, C. ; YANG, Y. FANG, T. ; LV, P. ; WANG, J. ; XU, J. ; LI, J. ; YU, C. ; HOU, L. ; BU, Z. ; CHEN, W. A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge. Nature Communications, v. 11, n. 1, p. 4081, 2020 doi: 10.1038/s41467-020-17972-1.
21-CORBETT, K. S. ; FLYNN, B. ; FOULDS, K. E. ; FRANCICA, J. R. ; BOYOGLU-BARNUM, S. ; WERNER, A. P. ; FLACH, B. ; O’CONNELL, S. ; BOCK, K. W. ; MINAI, M. NAGATA, B. M. ; ANDERSEN, H. ; MARTINEZ, D. R. ; NOE, A. T. ; DOUEK, N. ; DONALDSON, M. M. ; NJI, N. N. ; ALVARADO, G. S. ; EDWARDS, D. K. ; FLEBBE, D. R. LAMB, E. ; DORIA-ROSE, N. A. ; LIN, B. C. LOUDER, M. K. ; O’DELL, S. ; SCHMIDT, S. D. ; PHUNG, E. ; CHANG, L. A. ; YAP, C. ; TODD, J. M. ; PESSAINT, L. ; VAN RY. A. ; BROWNE, S. ; GREENHOUSE, J. PUTMAN-TAYLOR, T. ; STRASBAUGH, A. ; CAMPBELL, T. A. ; COOK, A. ; DODSON, A. ; STEINGREBE, K. ; SHI, W. ; ZHANG, Y. ; ABIONA, O. M. ; WANG, L. ; PEGU, A. ; YANG, E. S. ; LEUNG, K. ; ZHOU, T. TENG, I. T. ; WIDGE, A. ; GORDON, I. ; NOVIK, L. ; GILLESPIE, R. A. ; LOOMIS, R. J. MOLIVA, J. I. ; STEWART-JONES, G. HIMANSU, S. ; KONG, W. P. ; NASON, M. C. MORABITO, K. M. ; RUCKWARDT, T. J. LEDGERWOOD, J. E. ; GAUDINSKI, M. R. KWONG, P. D. ; MASCOLA, J. R. ; CARFI, A. ; LEWIS, M. G. ; BARIC, R. S. ; MCDERMOTT, A. ; MOORE, I. N. ; SULLIVAN, N. J. ; ROEDERER, M. ; SEDER, R. A. ; GRAHAM, B. S. Evaluation of the mRNA-1273 vaccine against SARS-CoV-2 in nonhuman primates. The New England Journal of Medicine, v. 383, n. 16, p. 1544-1555, 2020. doi: 10.1056/NEJMoa2024671.
22-VAN DOREMALEN, N. ; LAMBE, T. ; SPENCER, A. ; BELIJ-RAMMERSTORFER, S. ; PURUSHOTHAM, J. N. ; PORT, J. R. ; AVANZATO, V. ; BUSHMAKER, T. ; FLAXMAN, A. ULASZEWSKA, M. ; FELDMANN, F. ; ALLEN, E. R. ; SHARPE, H. ; SCHULZ, J. ; HOLBROOK, M. ; OKUMURA, A. ; MEADE-WHITE, K. ; PÉREZ-PÉREZ, L. ; BISSETT, C. ; GILBRIDE, C. ; WILLIAMSON, B. N. ; ROSENKE, R. ; LONG, D. ; ISHWARBHAI, A. ; KAILATH, R. ; ROSE, L. ; MORRIS, S. ; POWERS, C. ; LOVAGLIO, J. ; HANLEY, P. W. ; SCOTT, D. ; SATURDAY, G. ; DE WIT, E. ; GILBERT, S. C. ; MUNSTER, V. J. ChAdOx1 nCoV-19 vaccination prevents SARS-CoV-2 pneumonia in rhesus macaques. bioRxiv, v. 13, n. 05.13.093195, 2020. doi: 10.1101/2020.05.13.093195.
23-GRYZINSKI, V. Na era do novo vírus, quanto custa um macaco de laboratório? Veja, 2020. Disponível em: <https://veja.abril.com.br/blog/mundialista/na-era-do-novo-virus-quanto-custa-um-macaco-de-laboratorio/> Acesso em 11 de fevereiro de 2021.
24-POSTLETHWAIT, J. H. ; FARNSWORTH, D. R. ; MILLER, A. C. An intestinal cell type in zebrafish is the nexus for the SARS-CoV-2 receptor and the Renin-Angiotensin-Aldosterone System that contributes to COVID-19 comorbidities. bioRxiv, v. 2, n. 09.01.278366, p. 1-39, 2020. doi: 10.1101/2020.09.01.278366.
25-GALINDO-VILLEGAS, J. The zebrafish disease and drug screening model: a strong ally against Covid-19. Frontiers in Pharmacology, v. 11, n. 680, p. 1-2, 2020 doi: 10.3389/fphar.2020.00680.
26-FERNANDES, B. H. V. ; FEITOSA, N. M. ; BARBOSA, A. P. ; BOMFIM, C. G. ; GARNIQUE, A. M. B. ; GOMES, F. I. F. ; NAKAJIMA, R. T. ; BELO, M. A. A. ; ETO, S. F. ; FERNANDES, D. C. ; MALAFAIA, G. ; MANRIQUE, W. G. ; CONDE, G. ; ROSALES, R. R. C. ; TODESCHINI, I. ; RIVERO, I. ; LLONTOP, E. ; SGRO, G. G. ; OKA, G. U. ; BUENO, N. F. ; FERRARIS, F. K. ; DE MAGALHAES, M. T. Q. ; MEDEIROS, R. J. ; GOMES, J. M. M. ; DE SOUZA JUNQUEIRA, M. ; CONCEIÇÃO, K. ; PONTES, L. G. ; CONDINO-NETO, A. ; PEREZ, A. C. ; BARCELLOS, L. J. G. ; CORREA JUNIOR, J. D. ; DORLASS, E. G. ; CAMARA, N. O. S. ; DURIGON, E. L. ; CUNHA, F. Q. ; NÓBREGA, R. H. ; MACHADO-SANTELLI, G. M. ; FARAH, C. ; VERAS, F. P. ; GALINDO-VILLEGAS, J. ; COSTA-LOTUFO, L. ; CUNHA, T. M. ; CHAMMAS, R. ; GUZZO, C. R. ; CARVALHO, L. R. ; CHARLIE-SILVA, I. Zebrafish studies on the vaccine candidate to COVID-19, the Spike protein: production of antibody and adverse reaction. bioRxiv, p. 36-71, 2020. doi: 10.1101/2020.10.20.346262.
27-ROMERO, M. F. Covid-19: estudo investiga uso do zebrafish para testar segurança de vacinas. Rio de Janeiro: Fiocruz, 2020. Disponível em: <https://portal.fiocruz.br/noticia/covid-19-estudo-investiga-uso-do-zebrafish-para-testar-seguranca-de-vacinas>. Acesso em 11 de fevereiro de 2021.
28-TRÉZ, T. Considerações sobre o conceito dos 3Rs e o potencial conflito com novas compreensões do animal experimental. Revista Brasileira de Zoociências, v. 19, n. 2, p. 97-113, 2018.





