Acute spinal cord injury: pathophysiology and therapeutic options – review
Trauma medular agudo: fisiopatología y opciones terapéuticas – revisión
Clínica Veterinária, Ano XXIII, n. 135, p. 48-58, 2018
DOI: 10.46958/rcv.2018.XXIII.n.135.p.48-58
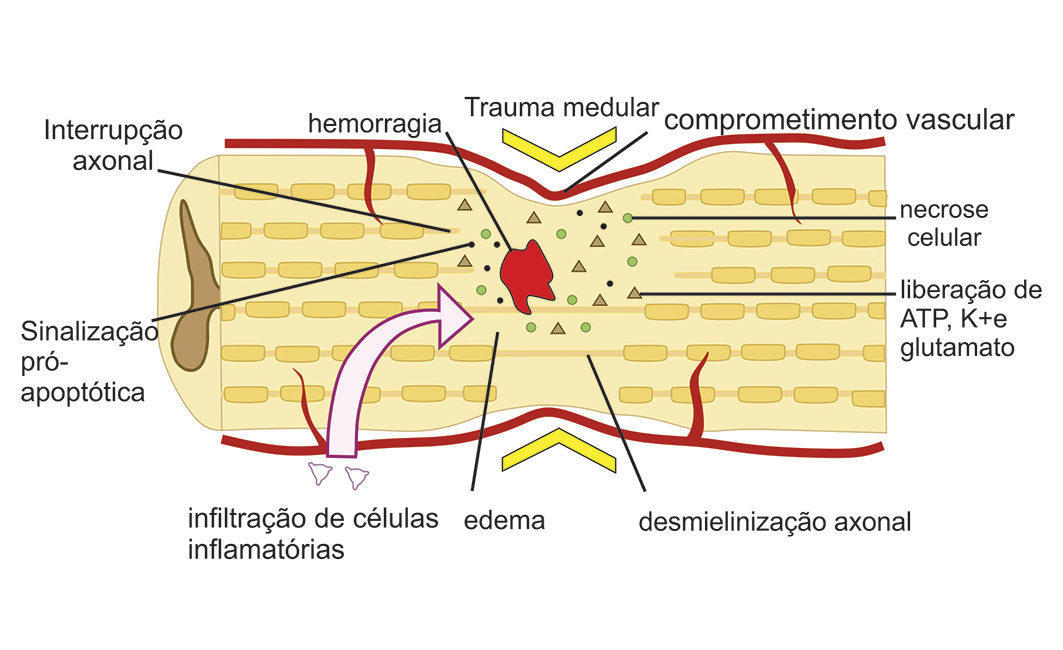
Resumo: O trauma medular pode resultar em incapacidade motora permanente, e seu tratamento ainda permanece um desafio. A lesão medular aguda inicia a sequência de eventos vasculares, bioquímicos e inflamatórios que ocasionam o desenvolvimento de lesões teciduais secundárias em diferentes tecidos, levando à destruição progressiva do tecido neuronal, com consequências frequentemente irreversíveis às funções motora e sensorial do paciente. Alguns estudos fizeram aumentar a compreensão dos mecanismos envolvidos na lesão medular aguda, e apesar de décadas de pesquisas objetivando a recuperação funcional e a qualidade de vida dos pacientes, o tratamento para essa condição ainda é frustrante. O presente artigo tem como objetivo compilar informações acadêmicas sobre a fisiopatologia e as principais propostas terapêuticas para trauma medular agudo.
Unitermos: neurologia, lesões, traumatismo, espinhal, tratamento
Abstract: Spinal cord trauma can result in permanent disability and its treatment remains a challenge. Spinal cord injury triggers a sequence of vascular, biochemical and inflammatory events that result in the development of secondary tissue lesions. The secondary injury leads to progressive destruction of neuronal tissue with frequently irreversible consequences to the patient’s motor and sensory functions. Studies have increased the understand of the mechanisms of spinal cord injury. But despite decades of research aiming at functional recovery and improved quality of life of patients, treatment for this condition is still frustrating. This article compiles academic information on pathophysiology and main therapeutic approaches for spinal cord injury.
Keywords: neurology, injuries, trauma, spinal cord, treatment
Resumen: El trauma medular puede llevar a una incapacidad motora permanente y su tratamiento aún representa un desafío. La lesión medular aguda gatilla una secuencia de eventos vasculares, bioquímicos e inflamatorios que ocasionan lesiones secundarias en diferentes tejidos, y que llevan a la destrucción progresiva del tejido nervioso, con consecuencias generalmente irreversibles en cuanto a las funciones motora y sensorial del paciente. Algunos estudios permitieron mejorar la comprensión de los mecanismos relacionados con la lesión medular aguda y, a pesar de que han pasado décadas realizándose investigaciones sobre la recuperación funcional y la calidad de vida de los pacientes, el tratamiento para esta patología es frustrante. El objetivo del presente trabajo fue recopilar informaciones académicas sobre la fisiopatología y las principales propuestas terapéuticas del trauma medular agudo.
Palabras clave: neurología, lesiones, traumatismo, espinal, tratamiento
Conteúdo exclusivo para assinantes
Seja um dos milhares de leitores que se beneficiam dos conteúdos da Clínica Veterinária
Acompanhamos sua jornada de autoconhecimento e evolução
Assine agora e junte-se à nossa comunidade
Digital
R$230,00
Ou escolha o seu plano
Assinatura digital, diretamente do nosso acervo com todas as edições publicadas, desde o nº 1.
Assinatura digital, diretamente do nosso acervo com todas as edições publicadas, desde o nº 1.
Assinatura digital, diretamente do nosso acervo com todas as edições publicadas, desde o nº 1.
AssinarAtualização científica e divulgação de informações para o médico-veterinário de pequenos animais
- Principal publicação científica de educação continuada do setor no país.
- Desde 1996, o veículo de referência para o médico-veterinário de pequenos animais.
- Indexada no Zoological Records CAB Abstracts, Latindex e Web of Science.
- Periodicidade bimestral, publicada na versão digital.
- Cobre as diversas especialidades da clínica veterinária de pequenos animais como dermatologia, cardiologia, neurologia, nefrologia, reprodução, endocrinologia, oftalmologia, incluindo também bem-estar animal, saúde pública, zoonoses, medicina veterinária de desastres medicina veterinária do coletivo, ecologia, animais silvestres, entre outras.
- Opção de assinatura digital. O leitor tem acesso ao conteúdo digital completo dos 30 anos de publicação.
- A cada nova edição bimestral, conteúdos importantes e atualizações para seu dia-a-dia profissional.
Atenção!!
Estudantes de medicina veterinária possuem CUPOM de 30% de desconto. Antes de concluir a compra, favor enviar um comprovante estudantil (carteirinha, um boleto atual ou uma certidão, válido para estudantes de graduação, pós-graduação, doutorado ou mestrado do curso de medicina veterinária) para o seguinte e-mail: [email protected] ou WhatsApp: (11) 98250-0016
Após o envio e confirmação, você receberá o cupom para finalizar sua compra.
Revista Clínica Veterinária.
Já é assinante? Clique e entre na sua conta!


