Sporotrichosis in a FeLV seropositive feline – case report
Esporotricosis en un gato FeLV positivo – relato de caso
Clínica Veterinária, Ano XXIII, n. 137, p. 58-68, 2018
DOI: 10.46958/rcv.2018.XXIII.n.137.p.58-68
Resumo: A esporotricose é uma micose subcutânea causada pelos fungos do complexo Sporothrix schenckii. Essa doença afeta homens e animais, sendo particularmente grave em gatos. A infecção ocorre principalmente pela inoculação traumática do fungo, ou seja, por meio de arranhaduras e mordeduras de animais infectados. Doenças imunossupressoras como a FeLV e a dificuldade na administração dos medicamentos são fatores que complicam o prognóstico desses pacientes. O objetivo do presente artigo é relatar o manejo terapêutico da esporotricose em um gato soropositivo para FeLV, que levou à regressão das lesões e a uma importante melhora clínica do paciente.
Unitermos: itraconazol, medicina felina, timomodulina, zoonose
Abstrac: Sporotrichosis is a subcutaneous mycosis caused by the fungi of the Sporothrix schencki complex. The disease affects men and animals and is particularly severe in cats. The infection is typically acquired by traumatic inoculation of the fungus through scratches and bites from infected animals. Prognosis is worse in patients with immunodepressive diseases such as FeLV, and when administration of treatment is challenging. We report the therapeutic management of sporotrichosis in a cat seropositive for FeLV. Treatment resulted in regression of lesions and marked improvement of clinical signs.
Keywords: itraconazole, feline medicine, thymomodulin, zoonosis
Resumen: La esporotricosis es una micosis subcutánea provocada por hongos del complejo Sporothrix schencki. Esta enfermedad puede afectar tanto al hombre como a los animales, siendo particularmente grave en los gatos. La infección se produce en general por inoculación traumática del hongo, es decir, mediante arañazos y mordeduras de animales infectados. Entre los factores que complican el pronóstico de estos pacientes pueden contarse, por un lado a las enfermedades inmunosupresoras como la FeLV, y por otro la dificultad que existe para la administración de medicamentos en esta especie. El objetivo del presente trabajo es relatar el manejo terapéutico de un gato con esporotricosis que era positivo para FeLV, en el cual se consiguió la regresión de las lesiones y una importante mejoría clínica del paciente.
Palabras claves: itraconazol, medicina felina, timomodulina, zoonosis
Introdução
A esporotricose é uma micose subcutânea causada pelos fungos do complexo Sporothrix schenckii, sendo o S. brasiliensis o de maior prevalência no Brasil. Os fungos desse complexo são dimórficos e sapróbios, ou seja, apresentam duas fases, sendo a fase filamentosa encontrada em matéria orgânica no ambiente (25 °C), e a fase leveduriforme, em animais acometidos pela micose 1. A infecção ocorre pela inoculação traumática do fungo, ou seja, por meio de arranhaduras ou mordeduras de animais infectados e, mais raramente, por contato com matéria orgânica contaminada. Após a infecção, começa o processo de incubação, que pode durar de uma semana a 90 dias, quando surgirão os sinais clínicos da doença. As manifestações iniciais predominantes são lesões ulcerativas ou nodulares no local da inoculação, podendo progredir localmente, disseminar-se para outras áreas cutâneas e, nos casos mais graves, para órgãos internos como pulmão, fígado e baço, entre outros 2-4. Diversos animais domésticos e silvestres podem ser acometidos pela doença, sendo os de maior interesse para os clínicos de pequenos animais os cães e principalmente os gatos. Essa afecção é mais prevalente em regiões de clima tropical e subtropical úmido. No Brasil, o número de casos de esporotricose cresce anualmente, sendo relatado em várias regiões; contudo, os locais com maior frequência são o estado do Rio de Janeiro 5 e a região sul do Rio Grande do Sul 6.
O padrão-ouro para diagnóstico é o isolamento do Sporothrix spp. em meios de cultura fúngica com ágar Sabouraud acrescido ou não de cloranfenicol e cicloheximida. Outros métodos diagnósticos também podem ser empregados, com destaque para a citologia, devido a sua alta sensibilidade (79%), praticidade e rapidez; também é possível diagnosticar a esporotricose por meio de exame histopatológico, reação em cadeia de polimerase (PCR) e imuno-histoquímica 2.
O tratamento para esporotricose representa um grande desafio, seja pelo seu custo, pela via de administração, duração, falta de conscientização e principalmente pelo seu potencial zoonótico, requerendo cuidados do tutor em relação ao manejo do felino. O fármaco de primeira escolha para essa afecção é o itraconazol, contudo, outros fármacos são relatados pela literatura, tais como o fluconazol, a terbinafina, a anfotericina B e o antitireoideano iodeto de potássio (KI) 4,7. Normalmente, além da terapia antifúngica, o paciente necessitará de outros fármacos, como antibióticos, imunomoduladores e analgésicos, além de cuidados de suporte, como hidratação e nutrição. O prognóstico é variável, podendo ser bom, na apresentação cutânea localizada, e ruim, nos quadros disseminados. Outro fator que pode influenciar o prognóstico são os pacientes positivos para FeLV, especialmente nos estágios avançados em que os sinais clínicos característicos dessa infecção estão presentes.
A FeLV é causada por um RNA vírus (vírus da leucemia felina), que se caracteriza por possuir fita simples e, ao ser transcrito pela enzima transcriptase reversa no DNA do hospedeiro, dá origem a um provírus que se integra no genoma celular dos gatos infectados. Existem quatro subgrupos de FeLV, que são classificados conforme a estrutura antigênica da glicoproteína do envelope gp70 8. O FeLV A e o FeLV T são geralmente associados a quadros imunossupressores; o FeLV B é associado a linfomas e leucemias; e o FeLV C, a anemias não regenerativas. Contudo, essas características podem variar conforme a resposta individual de cada gato 9. Uma vez infectados, há quatro possíveis desfechos: a infecção pode ser classificada como abortiva, quando o sistema imune impede a replicação viral, fazendo com que esses gatos não se tornem virêmicos; regressiva, quando ocorre um período transitório de viremia, porém o sistema imune consegue eliminar o vírus; e focal ou atípica, quando a replicação se limita a um sítio específico, como os olhos ou o intestino delgado; a quarta, e de pior prognóstico, é denominada progressiva, pois está associada a uma replicação viral maciça por um período prolongado (superior a 18 semanas), tornando esse paciente persistentemente virêmico e, após o período de incubação, altamente suscetível a desenvolver os sinais clínicos da doença, além de se tornar um foco de infecção para outros gatos 9,10.
O diagnóstico da FeLV pode ser realizado por PCR, Elisa, imunocromatografia, imunofluorescência e isolamento viral. O isolamento viral é considerado padrão-ouro para o diagnóstico de FeLV, porém raramente é utilizado na rotina clínica, devido à dificuldade da técnica e ao tempo necessário para a sua realização. A técnica de PCR detecta o RNA viral ou DNA proviral, a partir de sangue, medula óssea e tecidos. Essa técnica apresenta alta sensibilidade na detecção do antígeno p27; comparativamente, 10% dos gatos com resultado negativo no Elisa podem apresentar-se positivos pelo método de PCR. A PCR quantitativa consegue correlacionar altas leituras de vírus com a apresentação de viremia, porém não distingue gatos virêmicos dos não virêmicos, o que seria importante para o diagnóstico de infecções e doenças associadas ao vírus. Os testes Elisa e imunocromatrográfico apresentam alta sensibilidade e especificidade diagnóstica, podendo ser utilizados como exames de triagem durante o atendimento veterinário. Esses testes indicam a presença de um componente proteico do vírus da FeLV chamado p27 e permitem a análise simultânea da presença da IgG para FIV. O teste imunocromatográfico torna-se mais prático, pois não necessita de um laboratório especializado e fornece o diagnóstico de forma instantânea 9-12.
O tratamento para FeLV é complexo, devido à variabilidade e à quantidade de complicações que podem ocorrer. De um modo geral, as principais terapias específicas para tratamento da FeLV são imunomoduladores tais como o interferon (IFN), pois os antivirais se mostraram ineficazes in vivo 9,10. Os IFNs são polipeptídios moleculares com importante função na imunomodulação. Os dois empregados na medicina felina são o alfa humano e, mais recentemente, o interferon ômega felino; contudo, estudos mais recentes questionam a eficácia do interferon alfa 13 e encorajam o uso do interferon ômega na dose de 1 x 106 IU/kg a cada 24 horas 13,14. Esse fármaco não está disponível no Brasil. As terapias antivirais com fármacos como zidovudina e lamivudina também podem ser utilizadas, objetivando diminuir a carga viral e reduzir as complicações clínicas causadas pelo vírus, porém seus resultados em estudos in vivo não sustentam sua eficácia 13. Outros medicamentos e nutracêuticos são citados pela literatura, porém ainda com escasso embasamento científico. Entre eles, a timomodulina, um polipeptídio obtido a partir do lisado ácido do timo de vitelo. A timomodulina atua sobre células T, B e natural killers do sistema imunológico, e modula a proliferação e a diferenciação de células progenitoras na medula óssea; além dos seus efeitos terapêuticos, nenhuma toxicidade ou efeito adverso foram relatados. Em seres humanos, ela é indicada para pacientes com infecções respiratórias recorrentes, síndrome da imunodeficiência adquirida secundária a quimioterapia ou radioterapia e em pacientes oncológicos 15. Em gatos, nenhum estudo controlado foi realizado, contudo, a dose recomendada é de 15 mg/gato 16.
O objetivo do presente estudo foi relatar o sucesso terapêutico utilizando itraconazol, iodeto de potássio e timomodulina em um gato com esporotricose cutânea disseminada e soropositivo para FeLV.
Relato de caso
Foi atendido um felino, macho inteiro de aproximadamente um ano, escore corporal 2, sem raça definida. Durante a anamnese, o tutor relatou que fazia controle de endoparasitas no paciente e desconhecia as retroviroses felinas e também a necessidade da vacinação em gatos.
Ao ser questionado sobre as condições do seu domicílio, informou que morava em uma casa desprovida de tela na zona central de Pelotas, RS, e que o paciente tinha livre acesso à rua, sendo que nas proximidades da casa havia um grande número de gatos errantes. O gato foi atendido por apresentar lesões ulceradas e crostosas na região da face, nos membros torácicos e na cola. O tutor informou ainda que a primeira lesão havia acometido a face do animal cerca de 45 dias antes, e que os ferimentos haviam progredido gradativamente. Segundo ele, o paciente não apresentava prurido digno de nota.
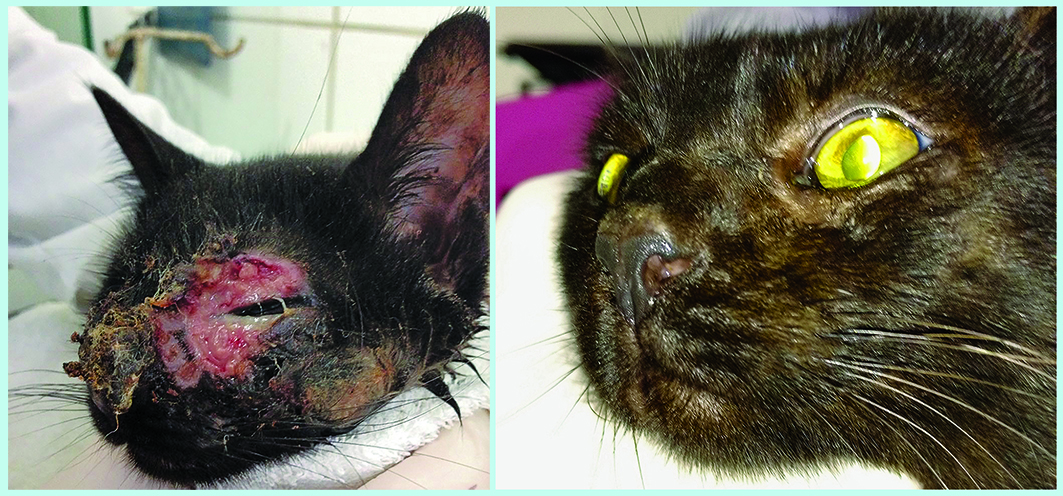
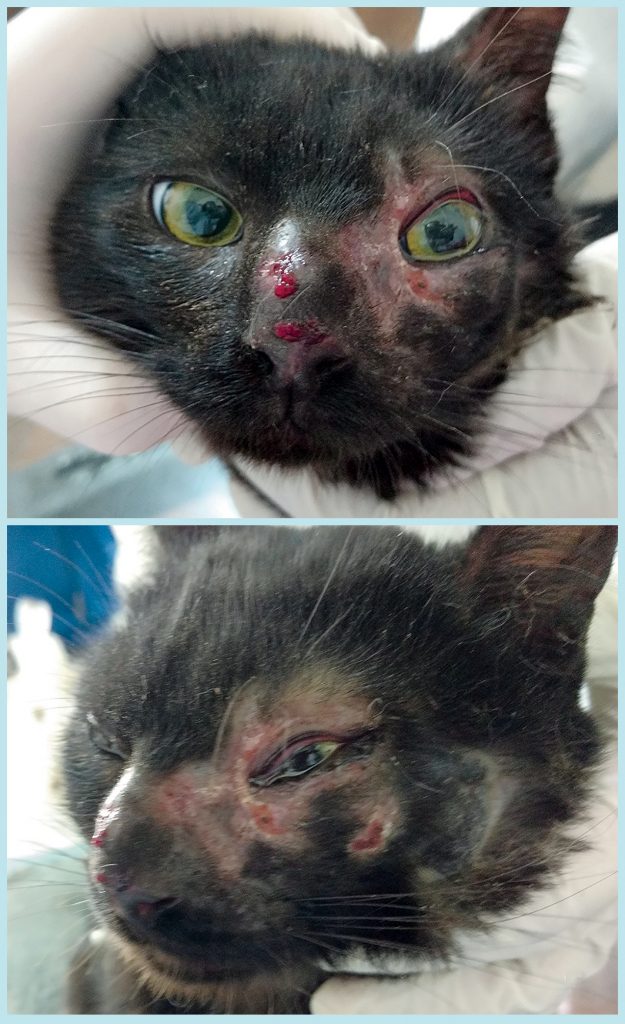
Durante o exame clínico geral, realizou-se auscultação cardíaca (sem anormalidades) e pulmonar, com discreto estertor em ambos os hemitórax. A temperatura retal aferida foi de 39,7 °C, com discreta desidratação, linfonodos mandibulares moderadamente reativos e sem alteração na palpação abdominal. Já no exame clínico específico foram observadas lesões ulceradas e crostosas na região dos planos nasal e periocular. Também se observaram quemose e secreção ocular purulenta no globo ocular esquerdo (Figura 1).
O paciente foi sedado com o auxílio de tramadol a 1 mg/kg e propofol b 6 mg/kg, e realizou-se a coleta de material para exames complementares. Para a cultura fúngica, as amostras foram colhidas com auxílio de swab estéril; a análise citológica foi realizada em amostras obtidas por inprint e coradas com panóptico rápido; já a análise histológica foi realizada em fragmento obtido por meio de biópsia, com auxílio de punch. Todas as amostras supracitadas foram coletadas da região facial do paciente. Também foi feita colheita de sangue para hemograma, bioquímicos e diagnóstico de FIV e FeLV. A avaliação diagnóstica para FIV e FeLV foi realizada pelo método imunocromatográfico, que identifica a presença do antígeno (p27) de FeLV e IgG contra o vírus da FIV.
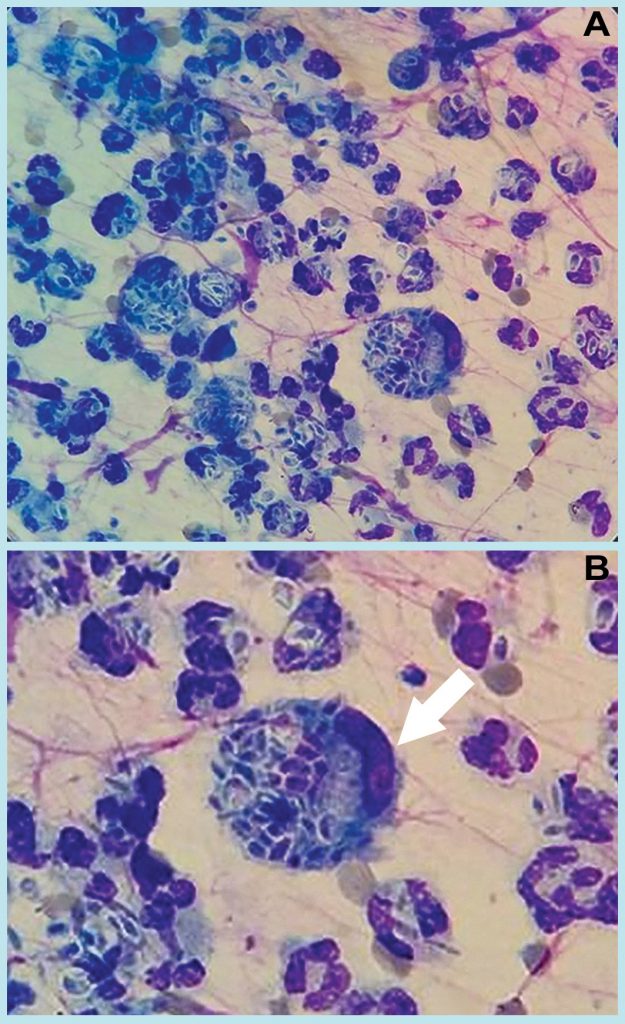
O exame citológico demonstrou estruturas leveduriformes arredondadas compatíveis com Sporothrix spp. (Figura 2); o hemograma revelou leucocitose, e os bioquímicos estavam dentro da normalidade para a espécie (Figura 3).
| Eritrograma | Dia 0 | Dia 21 | Dia 65 | Referência 17 |
| Hemácias | 7,1 | 7,52 | 8,59 | 5,92 a 9,93 x 106/mm3 |
| Hemoglobina | 9,8 | 10,2 | 10,7 | 9,3 a 15,9 g/dL |
| Hematócrito | 28 | 44 | 42,3 | 29 a 48% |
| VGM | 39,4 | 46,1 | 49,2 | 37 a 61 fL |
| CHGM | 35 | 22 | 25,3 | 30 a 38% |
| Proteínas totais | 7,8 | 6,5 | 6,8 | 6 a 8 g/dL |
| Plaquetas | 252 | 266 | 301 | 230 a 680 x 103/mm3 |
| Leucograma | Dia 0 | Dia 21 | Dia 65 | Referência 17 |
| Leucócitos totais | 24,2 | 11,49 | 10,7 | 3,5 a 16 x 103/mm3 |
| Mielócitos | 0 | 0 | 0 | 0 |
| Metamielócitos | 0 | 0 | 0 | 0 |
| Segmentados | 17,182 | 4,084 | 4,494 | 2,5 a 12,5 x 106/mm3 |
| Bastões | 0 | 0 | 0 | 0 a 600 x 103/mm3 |
| Linfócitos | 6,292 | 5,582 | 5,992 | 1,2 a 8 x 106/mm3 |
| Monócitos | 482 | 88 | 107 | 0 a 8 x 106/mm3 |
| Eosinófilos | 242 | 102 | 107 | 0 a 1,5 x 106/mm3 |
| Basófilos | 0 | 0 | 0 | raros |
| ALT | 22 | 79,4 | 56,3 | 10 a 100 UI/L |
| FA | 72 | 148,2 | 103,5 | 6 a 102 UI/L |
| Creatinina | 0,64 | 0,8 | 0,8 | 0,6 a 2,4 mg/dL |
| Ureia | 15 | 32 | 34 | 14 a 36 mg/dL |
| Albumina | 2,5 | 3,2 | 3,19 | 2,1 a 3,33 g/dL |
Figura 3 – Hemograma de paciente felino de um ano e soropositivo para FeLV com esporotricose durante o tratamento
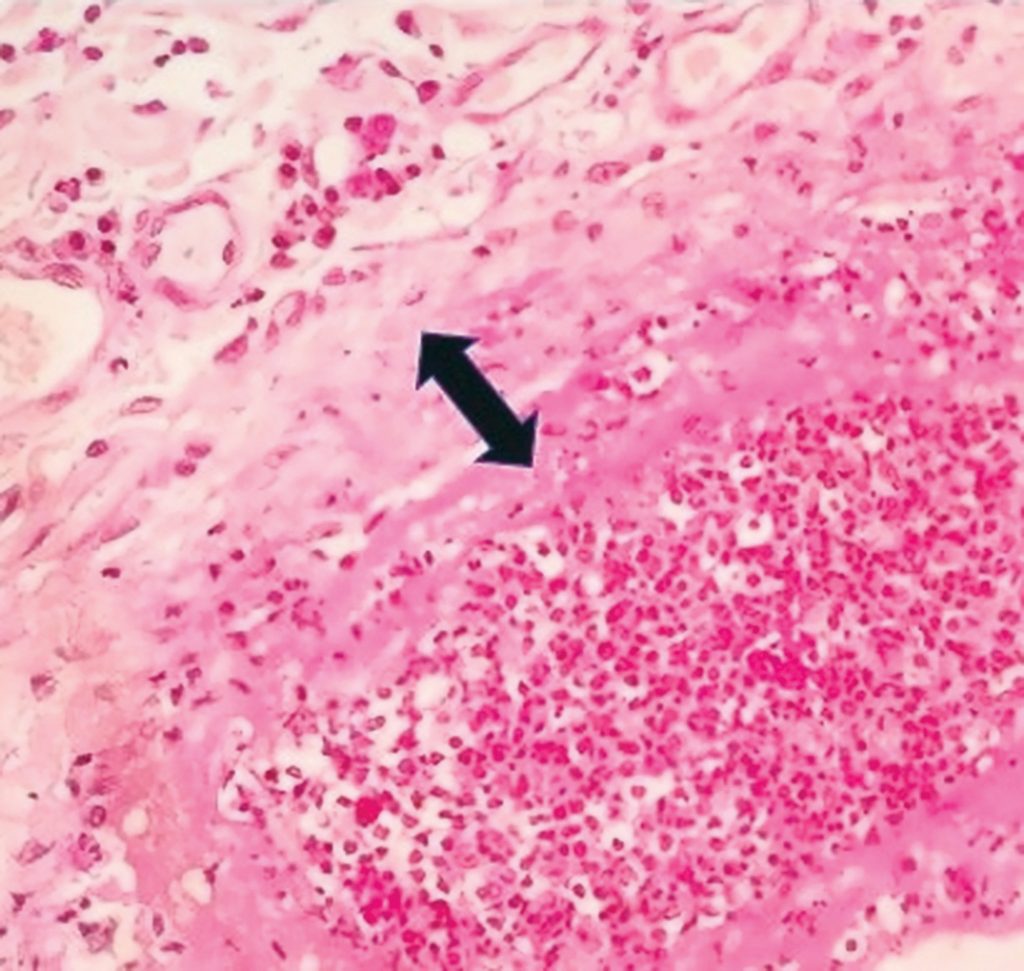
A cultura fúngica demonstrou, após dez dias, crescimento de colônias compatíveis com Sporothrix spp. (Figura 4), fato que foi confirmado após exame microscópico, enquanto no exame histopatológico foram visualizadas estruturas ovoides alongadas de aproximadamente 6 µm, eosinofílicas, com halo externo delgado característico de Sporothrix spp. (Figura 5).

Depois de avaliados os exames supracitados, o tutor foi instruído a não permitir acesso do animal à rua e a usar luvas descartáveis ao manipulá-lo. Iniciou-se o tratamento, por via oral, com o itraconazol d na dose de 100 mg/gato e iodeto de potássio e 5 mg/kg, ambos uma vez ao dia; amoxicilina com clavulanato de potássio f na dose de 25 mg/kg duas vezes ao dia por quinze dias; timomodulina g na dose de 4 mg/kg uma vez ao dia; cloridrato de tramadol 1 mg/kg duas vezes ao dia por cinco dias; e meloxican h 0,1 mg/kg uma vez ao dia por cinco dias. Recomendou-se ainda o tratamento tópico com tobramicina 0,3% i a cada 4 horas por dez dias e diclofenaco sódico j 1% a cada 8 horas durante cinco dias em ambos os olhos.
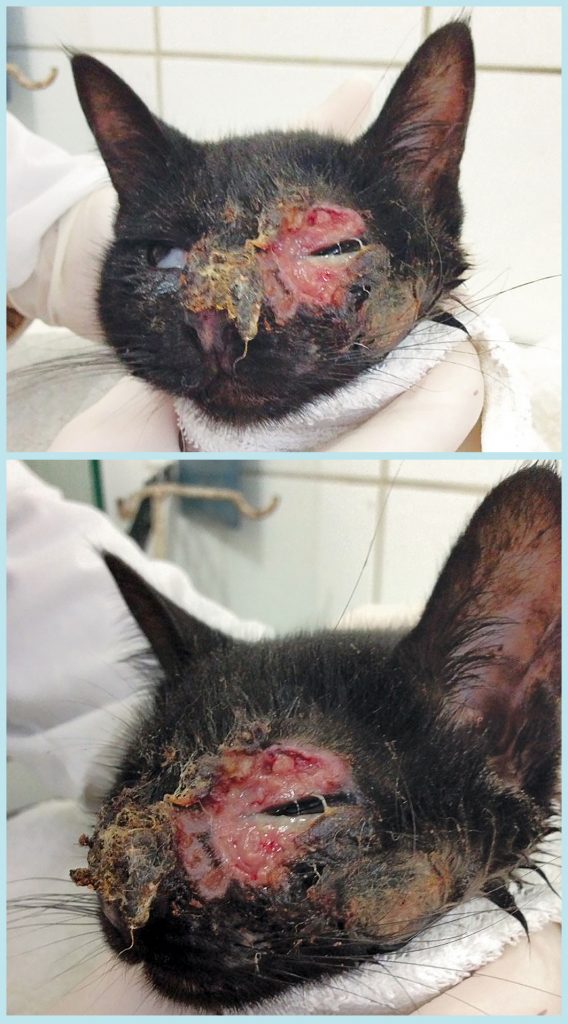
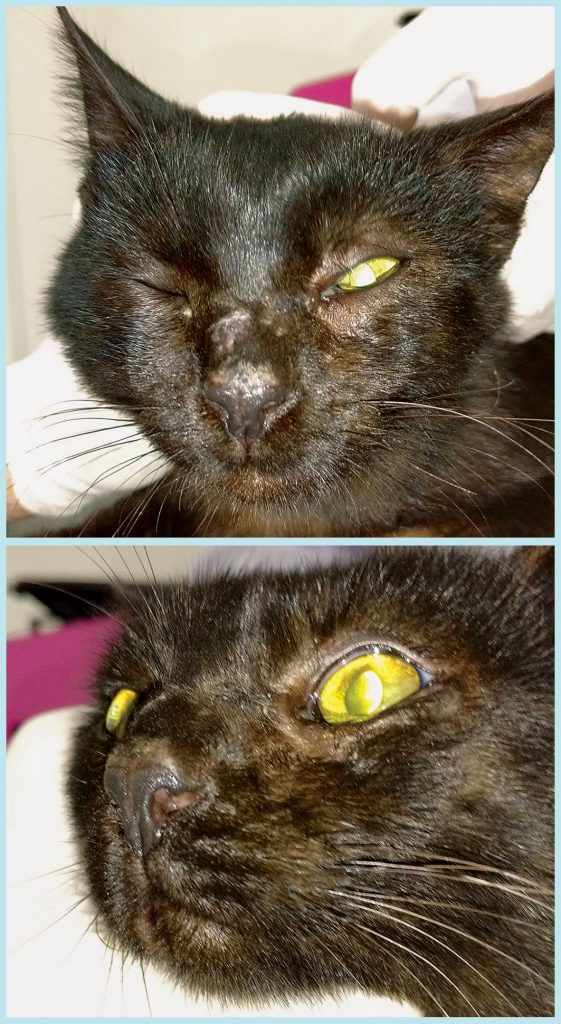
Após quinze dias de tratamento, o paciente já apresentava importante melhora clínica (Figura 6), com regularização dos parâmetros de normalidade do hemograma e da maioria dos bioquímicos, com exceção da fosfatase alcalina, que se encontrava discretamente aumentada (Figura 3).
Aos 65 dias de tratamento, observou-se a remissão completa das lesões; contudo, a terapia com itraconazol, iodeto de potássio e timomodulina foi mantida por mais 30 dias após a remissão (Figura 7).
Discussão
A esporotricose é uma doença emergente, e sua incidência aumenta em vários estados do país, entre os quais o Rio Grande do Sul 1,6, onde ocorreu o caso descrito. O diagnóstico definitivo foi realizado pela cultura fúngica, considerada padrão-ouro nessa micose 18; contudo, também foi possível confirmar o diagnóstico por meio de biópsia e avaliação citológica. No exame citológico foi possível identificar estruturas leveduriformes arredondadas. Outros autores informam a alta sensibilidade desse exame, que permite rápida e segura intervenção terapêutica 2. A realização desses exames permitiu descartar outras enfermidades semelhantes, tais como outras micoses – por exemplo, criptococose e histoplasmose –, e também neoplasias, como carcinoma de células escamosas 19.
O paciente em questão era um gato macho não vacinado com acesso à rua – o perfil clássico de portadores dessa doença 4,7. Os felinos com essas características são predispostos ao contato com matéria orgânica onde o fungo pode estar presente, assim como com gatos infectados, podendo contrair outras doenças, como a FeLV, além da esporotricose 9,10. A falta de informação e de conscientização relatada pelo tutor sobre a importância e os benefícios da castração, da vacinação para FeLV e da domiciliação felina representa um grande obstáculo para controlar a disseminação de doenças infectocontagiosas tais como a esporotricose e retroviroses na espécie felina, ressaltando assim o dever de o médico-veterinário disseminar essas informações.
A literatura mais recente relata o aumento de casos irresponsivos a monoterapia 4,18 e contraindica doses de itraconazol anteriormente recomendadas 7. O protocolo antifúngico utilizado nesse gato baseou-se na literatura recente, sendo utilizado o itraconazol na dose de 100 mg/gato, associado a iodeto na dose de 5 mg/kg. O itraconazol é um derivado triazólico sintético que apresenta um largo espectro de ação nas micoses superficiais e sistêmicas em animais 6. É o fármaco de escolha para felinos com esporotricose, devido a sua efetividade e segurança quando comparado aos demais agentes antifúngicos 20,21. Seu mecanismo de ação é primariamente fungistático, podendo ser fungicida em doses mais altas por meio da inibição do ergosterol das células fúngicas. Já o iodeto é um composto constituído de 76% de halogênio iodo e 23% de metal alcalino potássio. Seu mecanismo de ação ainda não foi plenamente elucidado, acreditando-se que auxilie a modulação da resposta inflamatória e possa causar dano à levedura pela conversão de iodeto de potássio em iodo 22. Essa associação também é descrita e utilizada com sucesso em seres humanos 23. No presente relato, a associação desses fármacos foi eficaz na remissão completa das lesões, além de ter se demonstrado segura, não sendo relacionada a sinais de toxicidade, tais como hiporexia, anorexia, vômitos, diarreias ou quadros de iodismo ou hepatotoxidade dignos de nota, comprovando assim os resultados de outros estudos que utilizaram protocolos similares em gatos com esporotricose 4,18.
A terapêutica incluiu outras medicações de suporte, dadas as infecções secundárias propiciadas pela esporotricose, em especial em um paciente candidato a apresentar falhas no sistema imunológico decorrentes da FeLV. Contudo, no presente caso não havia sinais clínicos que evidenciassem que o paciente apresentava a FeLV em seu estágio clínico 9,10. As infecções secundárias abrangiam a maioria dos locais acometidos pela micose, com presença de exsudato purulento e aumento de leucócitos no hemograma. Objetivando controlar essa infecção, utilizou-se amoxicilina com clavulanato de potássio, já que esse fármaco apresenta ótimas concentrações nos sistemas tegumentar e respiratório. Para o acometimento oftálmico realizou-se tratamento com colírio antibiótico (tobramicina) e anti-inflamatório (diclofenaco de sódio), pois os antibióticos sistêmicos não têm boa ação no globo ocular. O cloridrato de tramadol foi escolhido devido a sua ótima ação analgésica na espécie felina, e o meloxicam, devido a sua ação anti-inflamatória. Também se administrou o imunomodulador timomodulina na dose de 4 mg/kg, objetivando melhorar o sistema imunológico do paciente, dado o seu resultado encorajador quando empregado em seres humanos 16 e em cães 24.
O uso de imunomoduladores em doenças infecciosas é um tópico bastante controverso na medicina felina 25, especialmente pela ausência de estudos clínicos controlados que comprovem cientificamente sua eficácia 13. Entre os imunomoduladores mais amparados pela ciência, destacamos o interferon ômega recombinante 13. Esse fármaco demonstrou ser benéfico para gatos com FeLV, porém ainda não há relatos de seu uso em gatos com esporotricose. Sendo assim, optou-se pelo uso da timomodulina, por seus resultados positivos em seres humanos e em cães imunossuprimidos, não se observando nenhum sinal de toxicidade, de acordo com a literatura que relata a sua segurança em seres humanos 16 e em cães 24.
O caso relatado apresentou remissão completa das lesões oriundas da esporotricose, e não surgiram novas infecções durante os noventa dias subsequentes em que o animal foi avaliado. Embora o paciente tenha apresentado resposta positiva, ele era soropositivo para FeLV, cujos sinais clínicos estão relacionados a supressão medular, causando imunossupressão e anemia; contudo, esse gato não apresentava leucopenia nem anemia, sugerindo que, embora fosse soropositivo, ainda se encontrava assintomático ou com o vírus em fase de incubação 10. Desse modo, não foi possível inferir o impacto da FeLV na resposta terapêutica do paciente. Vale ressaltar que, mesmo com a remissão completa da esporotricose, o gato ainda precisará ser monitorado, pois pode vir a desenvolver quadros virêmicos nos próximos meses ou anos.
Conclusão
A associação de itraconazol, iodeto de potássio e timomodulina foi segura e eficaz no tratamento da esporotricose cutânea em um gato soropositivo para FeLV.
Produtos utilizados
a) Cronidor. Agener. São Paulo, SP, Brasil
b) Provive. Claris. São Paulo, SP, Brasil
c) Mycosel. Mbiologic Diagnósticos. Contagem, MG, Brasil
d) ITL 100 mg. Cepav. São Paulo, SP, Brasil
e) Iodeto de potássio. Vetpharma. Pelotas, RS, Brasil
f) Agemoxi CL. Agener. São Paulo, SP, Brasil
g) Leucogen. Aché. Guarulhos, SP, Brasil
h) Maxicam. Ourofino. Cravinhos, SP, Brasil
i) Tobramicina. Germed. São Paulo, SP, Brasil
j) Still. Alergan. Guarulhos, SP, Brasil
Agradecimentos
Os autores agradecem Haide Valeska Shield pelos conhecimentos técnicos em patologia.
Referências
01-OLIVEIRA, M. M. ; ALMEIDA-PAES, R. ; GUTIERREZ-GALHARDO, M. C. ; ZANCOPE-OLIVEIRA, R. M. Molecular identification of the Sporothrix schenckii complex. Revista Iberoamericana de Micología, v. 31, n. 1, p. 2-6, 2014. doi: 10.1016/j.riam.2013.09.008.
02-PEREIRA, S. A. ; MENEZES, R. C. ; GREMIÃO, I. D. ; SILVA, J. N. ; HONSE, C. O. ; FIGUEIREDO, F. B. ; DA SILVA, D. T. ; KITADA, A. A. ; DOS REIS, E. G. ; SCHUBACH, T. M. Sensitivity of cytopathological examination in the diagnosis of feline sporotrichosis. Journal of Feline Medicine and Surgery, v. 13, n. 4, p. 220-223, 2011. doi: 10.1016/j.jfms.2010.10.007.
03-LEME, L. R. ; SCHUBACH, T. M. ; SANTOS, I. B. ; FIGUEREIDO, F. B. ; PEREIRA, S. A. ; REIS, R. S. ; MELLO, M. F. ; FERREIRA, A. M. ; QUINTELLA, L. P. ; SCHUBACH, A. O. Mycological evaluation of bronchoalveolar lavage in cats with respiratory signs from Rio de Janeiro, Brazil. Mycoses, v. 50, n. 3, p. 210-214, 2007. doi: 10.1111/j.1439-0507.2007.01358.x.
04-REIS, É. G. ; SCHUBACH, T. M. ; PEREIRA, S. A. ; SILVA, J. N. ; CARVALHO, B. W. ; QUINTANA, M. S. ; GREMIÃO, I. D. Association of itraconazole and potassium iodide in the treatment of feline sporotrichosis: a prospective study. Medical Mycology, v. 54, n. 7, p. 684-690, 2016. doi: 10.1093/mmy/myw027.
05-PEREIRA, S. A. ; GREMIÃO, I. D. ; KITADA, A. A. ; BOECHAT, J. S. ; VIANA, P. G. ; SCHUBACH, T. M. The epidemiological scenario of feline sporotrichosis in Rio de Janeiro, State of Rio de Janeiro, Brazil. Revista da Sociedade Brasileira de Medicina Tropical, v. 47, n. 3, p. 392-393, 2014. doi: 10.1590/0037-8682-0092-2013.
06-NOBRE, M. O. ; MEIRELES, M. C. A. ; CAETANO, D. T. ; FAÉ, F. ; CORDEIRO, J. M. C. ; MEIRELES, R. M. ; APPELT, C. E. ; FERREIRO, L. Esporotricose zoonótica na região sul do Rio Grande do Sul (Brasil) e revisão de literatura brasileira. Revista Brasileira de Ciência Veterinária, v. 9, n. 1, p. 36-41, 2002. doi: 10.4322/rbcv.2015.347.
07-LLORET, A. ; HARTMANN, K. ; PENNISI, M. G. ; FERRER, L. ; ADDIE, D. ; BELÁK, S. ; BOUCRAUT-BARALON, C. ; EGBERINK, H. ; FRYMUS, T. ; GRUFFYDD-JONES, T. ; HOSIE, M. J. ; LUTZ, H. ; MARSILIO, F. ; MÖSTL, K. ; RADFORD, A. D. ; THIRY, E. ; TRUYEN, U. ; HORZINEK, M. C. Sporotrichosis in cats: ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery, v. 15, n. 7, p. 619-623, 2013. doi: 10.1177/1098612X13489225.
08-CHIU, E. S. ; HOOVER, E. A. ; VANDEWOUDE, S. A retrospective examination of feline leukemia subgroup characterization: viral interference assays to deep sequencing. Viruses, v. 10, n. 1, p. e29, 2018. doi: 10.3390/v10010029.
09-HARTMANN, K. Feline leukemia virus infection. In: GREENE, C. E. Infectious diseases of the dog and cat. 4 ed. St Louis: Elsevier Saunders. 2012. p. 108-136. ISBN: 978-1416061304.
10-LUTZ, H. ; ADDIE, D. ; BELÁK, S. ; BOUCRAUT-BARALON, C. ; EGBERINK, H. ; FRYMUS, T. ; GRUFFYDD-JONES, T. ; HARTMANN, K. ; HOSIE, M. J. ; LLORET, A. ; MARSILIO. F. ; PENNISI, M. G. ; RADFORD, A. D. ; THIRY, E. ; TRUYEN, U. ; HORZINEK, M. C. Feline leukaemia. ABCD guidelines on prevention and management. Journal of Feline Medicine and Surgery, v. 11, n. 7, p. 565-574, 2009. doi: 10.1016/j.jfms.2009.05.005.
11-KRECIC, M. R. VELINENI, S. ; MEEUS, P. ; FAN, H. ; LOENSER, M. Diagnostic performances of two rapid tests for detection of feline leukemia virus antigen in sera of experimentally feline leukemia virus-infected cats. Journal of Feline Medicine and Surgery Open Reports, v. 4, n. 1, p. 2055116917748117, 2018. doi: 10.1177/2055116917748117.
12-DUNHAM, S. P. ; GRAHAM, E. Retroviral infections of small animals. Veterinary Clinics of North America: Small Animal Practice, v. 38, n. 4, p. 879-901, 2008.
13-HARTMANN, K. Efficacy of antiviral chemotherapy for retrovirus-infected cats: what does the current literature tell us? Journal of Feline Medicine and Surgery, v. 17, n. 11, p. 925-939, 2015. doi: 10.1177/1098612X15610676.
14-DE MARI, K. ; MAYNARD, L. ; SANQUER, A. ; LEBREUX, B. ; EUN, H. M. Therapeutic effects of recombinant feline interferon-omega on feline leukemia virus (FeLV)-infected and FeLV/feline immunodeficiency virus (FIV)-coinfected symptomatic cats. Journal of Veterinary Internal Medicine, v. 18, n. 4, p. 477-482, 2004. doi: 10.1111/j.1939-1676.2004.tb02570.x.
15-FUKUDA, Y. ; JORDÃO-NEVES, B. M. ; CUNHA, J. ALBERNAZ, P. L. M. Estudo clínico-imunológico da eficácia de timomodulina (Leucogen®) na otite média aguda recorrente e na amigdalite de repetição. Pediatria Moderna, v. 35, n. 10, p. 828-834, 1999.
16-ANDRADE, S. F. Manual de terapêutica veterinária: consulta rápida. 1. ed. Rio de Janeiro: Roca, 2017. p. 240 e p. 317.
17-NORSWORTHY, D. G. ; AHO-VIITA, T. K. Normal laboratory value. In: NORSWORTHY, G. D. The feline patient. 4. ed. John Wiley & Sons. 2018. p. 977-978.
18-GREMIÃO, I. D. F. ; PEREIRA, S. A. ; RODRIGUES, A. M. ; FIGUEIREDO, F. B. ; NASCIMENTO JÚNIOR, A. ; SANTOS, I. B. ; SCHUBACH, T. M. P. Tratamento cirúrgico associado à terapia antifúngica convencional na esporotricose felina. Acta Scientiae Veterinariae, v. 34, n. 2, p. 221-223, 2006. ISSN: 1678-0345.
19-LAPPIN, M. R. Infecções micóticas. In. NELSON, R. W. ; COUTO, C. G. Medicina interna de pequenos animais. 5. ed. Rio de Janeiro: Elsevier, 2015. p. 1360-1364. ISBN:978-8535279061
20-PEREIRA, S. A. ; SCHUBACH, T. M. P. ; GREMIAO, I. D. F. ; SILVA, D. T. ; FIGUEIREDO, F. B. ; ASSIS, N. V. ; PASSOS, S. R. L. Aspectos terapêuticos da esporotricose felina. Acta Scientiae Veterinariae, v. 37, n. 4, p. 331-341, 2009; doi: 10.22456/1679-9216.16781.
21-PEREIRA, S. A. ; PASSOS, S. R. ; SILVA, J. N. ; GREMIAO, I. D. ; FIGUEIREDO, F. B. ; TEIXEIRA, J. L. ; MONTEIRO, P. C. ; SCHUBACH, T. M. Response to azolic antifungal agents for treating feline sporotrichosis. The Veterinary Record, v. 166, n. 10, p. 290-294, 2010-4. doi: 10.1136/vr.166.10.290.
22-TORRES-MENDONZA, B. M. ; VAZQUEZ-VALLS, E. ; GONZALES-MENDOZA, A. Effect of potassium iodide on the immune response in the sporotrichosis. Revista Iberoamericana de Micologia, v. 14, n. 3, p. 98-100, 1997.
23-MENDIRATTA, V. ; KARMAKAR, S. ; JAIN, A. ; JABEEN, M. Severe cutaneous zygomycosis due to Basidiobolus ranarum in a young infant. Pediatric Dermatology, v. 29, n. 1, p. 121-123, 2012. doi: 10.1111/j.1525-1470.2011.01476.x.
24-FERREIRA, M. L. G. ; MARTINS, D. C. ; DEGANI, V. A. N. Avaliação clínica e laboratorial de cadelas portadoras de neoplasia mamárias submetidas à quimioterapia adjuvante com gencitabina associada a carboplatina após mastectomina. 2014. Dissertação (Mestrado em Medicina Veterinária) – Universidade Federal Fluminense, Rio de Janeiro, 2014.
25-APPOLINÁRIO, C. M. ; MEGID, J. Uso de imunomoduladores nas enfermidades infecciosas dos animais domésticos. Semina: Ciências Agrárias, v. 28, n. 3, p. 437-448, 2007.


