Capivaras, carrapato-estrela e a febre maculosa brasileira
O elo entre amplificador, vetor e patógeno

A febre maculosa brasileira (FMB), a doença mais letal transmitida por carrapatos, tem a bactéria Rickettsia rickettsii como principal agente etiológico, com casos relatados no Brasil desde 1929 1. Apesar de poucos casos notificados nos 80 anos seguintes, a zoonose reemergiu na Região Sudeste, associada ao aumento significativo da população de capivaras (Hydrochoerus hydrochaeris) e seus carrapatos (Amblyomma sculptum), no início do século XXI, especialmente no estado de São Paulo 2.
A doença causada pela R. rickettsii tem como sinal clínico mais característico a ocorrência de erupções cutâneas ao quinto dia da infecção, além de quadro febril e sintomatologia inespecífica, particularmente no estado de São Paulo 3. Na ausência dessas erupções cutâneas, a enfermidade pode ser confundida com outras de quadro febril e maior prevalência na população, como dengue, doenças eruptivas virais e leptospirose 4.
A FMB tornou-se de notificação compulsória para o Ministério da Saúde em 2001 5. Com sua notificação imediata em 2014, os profissionais da saúde passaram a registrar casos suspeitos ou confirmados no Sistema de Informação de Agravos e Notificação (Sinan) dentro de 24 horas 6. Devido ao aumento do número de casos e à expansão das áreas de ocorrência, a FMB é atualmente considerada uma doença emergente no Brasil e endêmica em vários municípios da Região Sudeste 3,7.
O carrapato-estrela e a febre maculosa brasileira
Sendo o elo central entre a fonte de R. rickettsii e os seres humanos, os carrapatos adquirem a infecção por meio da alimentação em animais vertebrados sob bacteremia, chamados de hospedeiros amplificadores, ou ainda por transmissão transovariana 1,2.
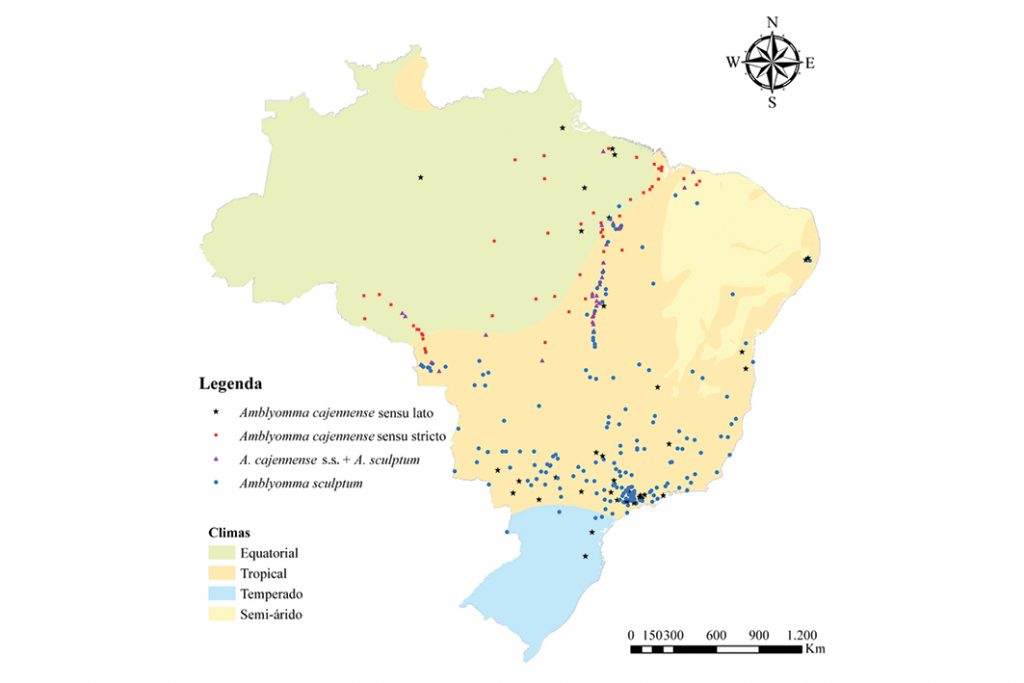
O Amblyomma cajennense lato sensu, popularmente conhecido como carrapato-estrela, era classificado no Brasil como uma única espécie até 2014 8. Estudos moleculares, morfológicos, biológicos e ecológicos demonstraram que esse táxon correspondia, na verdade, a duas espécies no país, o A. cajennense stricto sensu e o A. sculptum (Figura 1) 8,9.

O A. cajennense s. s. é de distribuição quase limitada ao clima equatorial e dentro do bioma da Amazônia, e o A. sculptum é de distribuição praticamente restrita ao clima tropical e dentro dos biomas Pantanal, Cerrado e áreas degradadas da Mata Atlântica, sendo mais comum na Região Sudeste (Figura 2) 9.
O A. sculptum apresenta uma geração por ano, com predomínio de larvas no outono, ninfas no inverno e adultos na primavera e no verão 10, sendo associado à vegetação nas áreas do Pantanal, Cerrado e em áreas degradadas da Mata Atlântica, coincidindo assim com espaços antrópicos 11. A infestação humana é frequente e pode ocorrer com dezenas a centenas de carrapatos por episódio, especialmente ninfas durante o inverno 12. As ninfas de A. sculptum são menores que os adultos, e também possuem alta agressividade e parasitismo pouco específico, disseminando-se amplamente sob a área infestada e com competência vetorial superior à de larvas infectadas pela R. rickettsii 13.
O carrapato A. sculptum é reconhecido como o principal vetor da FMB em áreas endêmicas no interior do estado de São Paulo 13. Apesar da competência vetorial, estudos experimentais com o carrapato A. sculptum demonstraram sua baixa eficiência em manter o agente R. rickettsii através de sucessivas gerações. Menos da metade das fêmeas ingurgitadas transmitiram verticalmente riquétsias, e somente parte da prole se tornou realmente infectada 13.
Além disso, a bactéria também é patogênica para os carrapatos, redundando em menor desempenho reprodutivo 13. Os ovos de A. sculptum só podem ser infectados se a geração anterior adquirir infecção nas fases de larva ou ninfa, já que o tempo de infecção pela R. rickettsii em carrapatos é superior ao tempo de postura 15,16. Sendo assim, a manutenção da R. rickettsii no ambiente depende da transmissão horizontal de hospedeiros amplificadores, possibilitando que novos carrapatos se infectem e participem na formação de linhagens infectadas 15,16.
Capivaras como principais hospedeiros amplificadores
As capivaras são mamíferos roedores abundantes em áreas endêmicas da FMB, especialmente no estado de São Paulo, sendo hospedeiras primárias de todos os estágios parasitários de A. sculptum 17. Consideradas os maiores roedores do mundo, de hábito semiaquático e gregário, que dependem da água para sua reprodução, regulação térmica e proteção contra predadores, encontram-se amplamente distribuídas em habitats naturais e antrópicos 18. Foram consideradas ameaçadas de extinção em 1950, mas fatores como a proibição da caça pela lei de proteção à fauna, o declínio de potenciais predadores naturais e a alta capacidade reprodutiva e capacidade de suporte do ambiente, associados ao aumento do cultivo da cana de açúcar, possibilitaram significativo aumento populacional 19. Coincidentemente, áreas antrópicas como parques urbanos e periurbanos com corpos de água, jardins de condomínios residenciais e empresas têm sido ambientes adequados tanto para capivaras quanto para seus carrapatos 20.
Em 1940, estudos com infecção experimental relataram que capivaras inoculadas com a R. rickettsii não apresentaram febre durante o período de riquetsemia, sugerindo que fossem amplificadoras do patógeno 20. A reemergência de casos de FMB no estado de São Paulo, concomitante ao aumento populacional de capivaras, fez ressurgir a suspeita de que elas fossem verdadeiros hospedeiros amplificadores 16. Em um estudo mais atual, as capivaras foram divididas em dois grupos e infectadas experimentalmente por A. sculptum e pela inoculação intraperitoneal de bactérias 16. Depois de infectadas, as capivaras mantiveram a R. rickettsii na circulação sanguínea em torno de 7 a 10 dias 16. Nesse período, foram capazes de infectar 20 a 25% e, por inoculação, 30 a 35% dos carrapatos, comprovando a sua capacidade de amplificar o patógeno 16.
Todas as capivaras têm a mesma suscetibilidade e podem ser infectadas por larvas, ninfas ou adultos do carrapato A. sculptum 16. Dessa forma, o ciclo da doença se perpetua em um grupo de capivaras à medida que novos indivíduos suscetíveis (nascimento e imigração) incrementam o grupo. Após a bacteremia, a resposta imune desenvolvida protege o animal de novas infecções 16, ou seja, a manutenção de capivaras adultas já resistentes por vasectomia ou laqueadura é mais interessante que a retirada parcial, que poderá se refletir em futuros filhotes ou jovens suscetíveis (Figura 3).

Classificação de áreas quanto à febre maculosa brasileira e manejo populacional de capivaras
A Secretaria do Meio Ambiente (SMA) e a Superintendência de Controle de Endemias (Sucen), ambas do estado de São Paulo, publicaram uma resolução conjunta em 2016 com diretrizes de manejo populacional de capivaras como uma das ferramentas para controle da FMB, associada ao seu inquérito sorológico 21. A resolução também propôs uma nova classificação das áreas de ocorrência da FMB, baseada na notificação de caso suspeito confirmado ou compatível com a doença: áreas silenciosas; áreas sem infestação; áreas infestadas – sendo este item subdividido em: áreas de risco; áreas de transmissão; áreas predispostas; e áreas de alerta (Figuras 4 e 5) 21.
| Tipo de área | Presença do vetor Amblyomma, soroprevalência de capivaras e outros animais |
Tipo de manejo das capivaras |
| Silenciosa | Sem informações da ocorrência do vetor. Necessidade de estimular notificação de parasitismo humano por Amblyomma | Controle populacional por translocação e vasectomia/laqueadura |
| Sem infestação | Após duas pesquisas acarológicas de Amblyomma (intervalo mínimo de 3 e máximo de 6 meses) | Controle populacional por translocação e vasectomia/laqueadura |
| Com infestação | Após pesquisa acarológica de Amblyomma | |
| – de transmissão | LPI* casos notificados nos últimos 10 anos | Controle populacional por vasectomia/laqueadura ou eutanásia |
| – de risco | Superior a 10% ou no mínimo 1 animal-título ≥ 2.048 | Controle populacional por vasectomia/laqueadura ou eutanásia |
| – predisposta | Presença de hospedeiros amplificadores | Coleta de material biológico. Controle populacional por vasectomia/laqueadura ou eutanásia |
| – de alerta | Baixa infestação por carrapatos. Animais-títulos < 2.048 | Coleta de material biológico. Controle populacional por vasectomia/laqueadura ou eutanásia |
Figura 4 – Classificação de áreas quanto à febre maculosa brasileira no estado de São Paulo 21 *LPI= Local provável de infecção
| Tipo de área de alerta | Tamanho da amostra e espécie | Periodicidade | Repetições de análises |
| Com alta frequência humana e abundância de capivaras, como parques e campi universitários | Amostragem de capivaras segundo fórmula: n*= 83 x N**) / (83 +N**) |
12 meses | Ano todo |
| Condomínios ou propriedades rurais com presença de capivaras | Amostragem de capivaras segundo fórmula: n*= 83 x N**) / (83 +N**) |
24 meses | De maio a novembro*** |
| Condomínios, propriedades rurais ou áreas públicas sem presença de capivaras e com presença de cavalos | Mínimo de 15 equinos entre 2 e 20 anos de idade; pelo menos 3 anos na área | 36 meses | De maio a novembro*** |
| Comunidades adjacentes a áreas de Mata Atlântica e presença do carrapato Amblyomma aureolatum ou Amblyomma ovale | Mínimo de 30 cães saudáveis; 1 a 6 anos de idade que tenham acesso à mata | 36 meses | Qualquer época do ano |
Figura 5 – Avaliação periódica das áreas de alerta para a febre maculosa brasileira, por meio de pesquisa sorológica 21
*n representa o tamanho da amostra.
**N representa o número de indivíduos adultos do grupo.
***Período em que as fases imaturas do carrapato Amblyomma sculptum procuram hospedeiros para alimentação. Visa representar a geração de carrapatos do ano vigente
Em áreas endêmicas para a FMB, cerca de 50 a 80% das capivaras são soropositivas para R. rickettsii 22. A reação de imunofluorescência indireta (Rifi) é o teste de referência para a FMB – com utilização de antígenos para R. rickettsii e Rickettsia parkeri –, realizado em laboratórios públicos ou privados credenciados junto à Sucen 21.
Em estudo recente, um modelo matemático foi utilizado para avaliar o papel das capivaras na dinâmica de transmissão da R. rickettsii. Descobriu-se que, em área não endêmica, a introdução de uma única capivara infectada com pelo menos um carrapato infectado é suficiente para estabelecer uma nova área endêmica 22. O mesmo estudo matemático considerou apenas a taxa de natalidade como fator para incremento populacional em um grupo de capivaras e observou que um declínio de 80% levou ao desaparecimento de capivaras infectadas no quarto ano 22. Já um declínio de 90% na taxa de natalidade levou ao desaparecimento de capivaras infectadas no segundo ano 22.
Nessas áreas de risco e transmissão, a principal estratégia de redução da natalidade pode ser a diminuição da capacidade de suporte do ambiente (o corte baixo da massa vegetal, o controle reprodutivo e a eutanásia) 22. O manejo reprodutivo por métodos contraceptivos é interessante em locais sem possibilidade de cercamento, enquanto a eutanásia de grupos inteiros pode ser necessária em áreas com cercamento completo e onde não haja possibilidade de reintrodução 21. Apesar de alterar o comportamento reprodutivo natural da fauna nativa, a vasectomia ou a laqueadura de capivaras não tem se mostrado prejudicial para o comportamento de indivíduos ou grupos, como defesa de território e migração 23.
As larvas e ninfas de A. sculptum também se alimentam em proporções menores de outros mamíferos e aves, porém, além da sua capacidade generalista de parasitismo, os carrapatos em vida livre residem em vegetação acima de 15 cm do solo, altura que facilita seu ataque às capivaras 24. Desse modo, as capivaras representam a única espécie amplificadora de maior porte capaz de albergar significativa população de A. sculptum em parte das áreas endêmicas de FMB 25.
Os javalis (Sus scrofa) são espécies de mamíferos de grande porte, não nativos e invasores, hospedeiros mantenedores confirmados de grandes populações de A. sculptum 28. A ampla distribuição e o expressivo aumento da densidade populacional de javalis em áreas endêmicas de FMB, localizadas principalmente nas mesmas áreas de cultivo de cana de açúcar da região Sudeste do Brasil, têm sido um alerta para o aumento da doença 28. Além disso, como as capivaras também apresentam um aumento populacional desequilibrado, com densidade populacional até 40 vezes maior em áreas endêmicas que em ambientes naturais 26, essa sobreposição de habitats entre javalis e capivaras pode ter impacto na ocorrência de carrapatos e doenças transmitidas por esses vetores, particularmente a FMB.
Considerações finais
A notificação da FMB é obrigatória e imediata (dentro de 24 horas) no Sinan desde 2014. O carrapato-estrela é na verdade o nome popular de duas espécies, o A. cajennense s. s. e o A. sculptum. As capivaras são mamíferos roedores abundantes em áreas endêmicas de FMB, especialmente no estado de São Paulo, sendo hospedeiras primárias de todos os estágios parasitários de A. sculptum.
A translocação e a vasectomia/laqueadura de capivaras podem ser consideradas no manejo populacional de áreas geográficas não infestadas/silenciosas por FMB, sejam elas fisicamente abertas ou fechadas. A vasectomia/laqueadura de capivaras deve ser considerada tanto em áreas abertas de risco como de transmissão da doença, buscando aumento proporcional de adultos resistentes e redução de filhotes e jovens suscetíveis. A eutanásia de capivaras deve ser considerada em áreas de risco e transmissão de FMB quando a área geográfica é fechada.
Finalmente, a superpopulação e a sobreposição de habitats entre capivaras e javalis pode ter impacto na ocorrência de carrapatos, particularmente o A. sculptum, bem como de doenças transmitidas por carrapatos, particularmente a FMB.
Referências
01-SZABÓ, M. P. J. ; PINTER, A. ; LABRUNA, M. B. Ecology, biology and distribution of spotted-fever tick vectors in Brazil. Frontiers in Cellular and Infection Microbiology, v. 3, n. 27, p. 1-9, 2013. doi: 10.3389/fcimb.2013.00027.
02-LABRUNA, M. B. Ecology of Rickettsia in South America. Annals of the New York Academy of Sciences, v. 1166, n. 1, p. 156-166, 2009. doi: 10.1111/j.1749-6632.2009.04516.
03-SANGIONI, L. A. ; HORTA, M. C. ; VIANNA, M. C. B. ; GENNARI, S. M. ; SOARES, R. M. ; GALVÃO, M. A. M. ; SCHUMAKER, T. T. S. ; FERREIRA, F. ; VIDOTTO, O. ; LABRUNA, M. B. Rickettsial infection in animals and Brazilian spotted fever endemicity. Emerging Infectious Diseases, v. 11, n. 2, p. 266-270, 2005. doi: 10.3201/eid1102.040656.
04-ANGERAMI, R. N. ; CÂMARA, M. ; PACOLA, M. R. ; REZENDE, R. C. M. ; DUARTE, R. M. R. ; NASCIMENTO, E. M. M. ; COLOMBO, S. ; SANTOS, F. C. ; LEITE, R. M. ; KATZ, G. ; SILVA, L. J. Features of Brazilian spotted fever in two different endemic areas in Brazil. Ticks and Tick-Borne Diseases, v. 3, n. 5-6, p. 346-348, 2012. doi: 10.1016/j.ttbdis.2012.10.010.
05-BRASIL. Portaria n° 1.943, de 18 de outubro de 2001. Define a relação de doenças de notificação compulsória para todo território nacional. Informe Epidemiológico do SUS, v. 10, n. 1, p. 57-58, 2001. Doi: 10.5123/S0104-16732001000100007.
06-BRASIL. Portaria n° 204, de 17 de fevereiro de 2016. Define a Lista Nacional de Notificação Compulsória de doenças, agravos e eventos de saúde pública nos serviços de saúde públicos e privados em todo o território nacional, nos termos do anexo, e dá outras providências. Ministério da Saúde, 2016. Disponível em: <http://portalarquivos2.saude.gov.br/images/pdf/2018/abril/25/Portaria-n—2014-de-17–Fevereiro-2016.pdf>. Acessado em: 19 de novembro de 2018.
07-OLIVEIRA, S. V. ; GUIMARÃES, J. N. ; RECKZIEGEL, G. C. ; NEVES, B. M. C. ; ARAÚJO-VILGES, K. M. ; FONSECA, L. X. ; PINNA, F. V. ; PEREIRA, S. V. C. ; CALDAS, E. P. ; GAZETA, G. S. ; GURGEL-GONÇALVES, R. An update on the epidemiological situation of spotted fever in Brazil. Journal of Venomous Animals and Toxins Including Tropical Diseases, v. 22, n. 22, p. 1-8, 2016. doi: 10.1186/s40409-016-0077-4.
08-NAVA, S. ; BEATI, L. ; LABRUNA, M. B. ; CÁCERES, A. G. ; MANGOLD, A. J. ; GUGLIELMONE, A. A. Reassessment of the taxonomic status of Amblyomma cajennense (Fabricius, 1787) with the description of three new species, Amblyomma tonelliae n. sp., Amblyomma interandinum n. sp. and Amblyomma patinoi n. sp., and reinstatement of Amblyomma mixtum, and Amblyomma sculptum (Ixodida: Ixodidae). Ticks Tick-Borne Diseases, v. 5, n. 3, p. 252-276, 2014. doi: 10.1016/j.ttbdis.2013.11.004.
09-MARTINS, T. F. ; BARBIERI, A. R. M. ; COSTA, F. B. ; TERASSINI, F. A. ; CAMARGO, L. M. A. ; PETERKA, C. R. L. ; PACHECO, R. C. ; DIAS, R. A. ; NUNES, P. H. ; MARCILI, A. ; SCOFIELD, A. ; CAMPOS, A. K. ; HORTA, M. C. ; GUILLOUX, A. G. A. ; BENATTI, H. R. ; RAMIREZ, D. G. ; BARROS-BATTESTI, D. M. ; LABRUNA, M. B. Geographical distribution of Amblyomma cajennense (sensu lato) ticks (Parasitiformes: Ixodidae) in Brazil, with description of the nymph of A. cajennense (sensu stricto). Parasites & Vectors, v. 9, n. 186, p. 1-14, 2016. doi: 10.1186/s13071-016-1460-2.
10-LABRUNA, M. B. ; KASAI, N. ; FERREIRA, F. ; FACCINI, J. L. H. ; GENNARI, S. M. Seasonal dynamics of ticks (Acari: Ixodidae) on horses in the state of São Paulo, Brazil. Veterinary Parasitology, v. 105, n. 1, p. 65-77, 2002. doi: 10.1016/s0304-4017(01)00649-5.
11-LABRUNA, M. B. ; JORGE, R. S. P. ; SANA, D. A. ; JÁCOMO, A. T. A. ; KASHIVAKURA, C. K. ; FURTADO, M. M. ; FERRO, C. ; PEREZ, S. A. ; SILVEIRA, L. ; SANTOS Jr., T. S. ; MARQUES, S. R. ; MORATO, R. G. ; NAVA, A. ; ADANIA, C. H. ; TEIXEIRA, R. H. ; GOMES, A. A. ; CONFORTI, V. A. ; AZEVEDO, F. C. ; PRADA, C. S. ; SILVA, J. C. ; BATISTA, A. F. ; MARVULO, M. F. ; MORATO, R. L. ; ALHO, C. J. ; PINTER, A. ; FERREIRA, P. M. ; FERREIRA, F. ; BARROS-BATTESTI, D. M. Ticks (Acari: Ixodidae) on wild carnivores in Brazil. Experimental & Applied Acarology, v. 36, n. 1-2, p. 149-163, 2005. doi: 10.1007/s10493005-2563-1.
12-PINTER, A. ; FRANÇA, A. C. ; SOUZA, C. E. ; SABBO, C. ; NASCIMENTO, E. M. M. ; SANTOS, F. C. P. ; KATZ, G. ; LABRUNA, M. B. ; HOLCMAN, M. M. ; ALVES, M. J. C. P. ; HORTA, M. C. ; MASCHERETTI, M. ; MAYO, R. C. ; ANGERAMI, R. N. ; BRASIL, R. A. ; LEITE, R. M. ; SOUZA, S. S. A. L. ; COLOMBO, S. ; OLIVEIRA, V. C. M. Febre maculosa brasileira. Suplemento Bepa, v. 8, n. 1, p. 1-32, 2011. ISSN: 1806-4272.
13-SOARES, J. F. ; SOARES, H. S. ; BARBIERI, A. M. ; LABRUNA, M. B. Experimental infection of the tick Amblyomma cajennense, Cayenne tick, with Rickettsia rickettsii, the agent of Rocky Mountain spotted-fever. Medicine and Veterinary Entomology, v. 26, n. 2, p. 139-151, 2012. doi: 10.1111/j.1365-2915.2011.00982.
14-POLO, G. ; LABRUNA, M. B. ; FERREIRA, F. Basic reproduction number for the Brazilian Spotted Fever. Journal of Theoretical Biology, v. 458, p. 119-124, 2018. doi: 10.1016/j.jtbi.2018.09.011.
15-DUMLER, J. S. ; WALKER, D. H. Rocky Mountain spotted fever – changing ecology and persisting virulence. The New England Journal of Medicine, v. 353, n. 6, p. 551-553, 2005. doi: 10.1056/nejmp058138.
16-SOUZA, C. E. ; MORAES-FILHO, J. ; OGRZEWALSKA, M. ; UCHOA, F. C. ; HORTA, M. C. ; SOUZA, S. S. L. ; BORBA, R. C. ; LABRUNA, M. B. Experimental infection of capybaras Hydrochoerus hydrochaeris by Rickettsia rickettsii and evaluation of the transmission of the infection to ticks Amblyomma cajennense. Veterinary Parasitology, v. 161, n. 1-2, p. 116-121, 2009. doi: 10.1016/j.vetpar.2008.12.010.
17-VIEIRA, A. M. L. ; SOUZA, C. E. ; LABRUNA, M. B. ; MAYO, R. C. ; SOUZA, S. S. L. ; CAMARGO-NEVES, V. L. F. Manual de Vigilância Acarológica – Estado de São Paulo. São Paulo: Secretaria de Estado da Saúde, 2004. 62 p.
18-MOREIRA, J. R. ; MACDONALD, D. W. Capybara use and conservation in South America. In: TAYLOR, V. J. ; DUNSTONE, N. The exploitation of mammal populations. Berlin: Springer, 1996. p. 88-101. ISBN: 978-0-412-64420-7.
19-FERRAZ, K. M. P. M. B. ; FERRAZ, S. F. B. ; MOREIRA, J. R. ; COUTO, H. T. Z. ; VERDADE, L. M. Capybara (Hydrochoerus hydrochaeris) distribution in agroecosystems: a cross-scale habitat analysis. Journal of Biogeography, v. 34, n. 2, p. 223-230, 2007. doi: 10.1111/j.1365-2699.2006.01568.
20-TRAVASSOS, J. ; VALLEJO, A. Comportamento de alguns cavídeos (Cavia aperea e Hydrochoerus capybara) às inoculações experimentais do vírus da Febre Maculosa. Possibilidade de esses cavídeos representarem o papel de depositários transitórios do vírus na natureza. Memórias Instituto Butantan, v. 15, p. 73-86, 1942.
21-GOVERNO DO ESTADO DE SÃO PAULO. Resolução conjunta SMA/SUCEN nº 01, de 24 de março de 2016. Dispõe sobre a aprovação das “Diretrizes técnicas para a vigilância e controle da Febre Maculosa Brasileira no Estado de São Paulo – classificação de áreas e medidas preconizadas”, e dá outras providências. São Paulo, 2016. Disponível em: <http://arquivos.ambiente.sp.gov.br/legislacao/2016/12/Resolu%C3%A7%C3%A3o-Conjunta-SMA-SUCEN-001-2016-Processo-15257-2011-Aprova%C3%A7%C3%A3o-das-diretrizes-t%C3%A9cnicas-para-vigil%C3%A2ncia-e-controle-da-febre-maculosa-brasileira-no-Estado-de-SP.pdf>. Acessado em 19 de novembro de 2018.
22-POLO, G. ; ACOSTA, C. M. ; LABRUNA, M. B. ; FERREIRA, F. Transmission dynamics and control of Rickettsia rickettsii in populations of Hydrochoerus hydrochaeris and Amblyomma sculptum. PLOS Neglected Tropical Diseases, v. 11, n. 6, p. 1-12, 2017. doi: 10.1371/journal.pntd.0005613.
23-RODRIGUES, M. V. Aspectos ecológicos e controle reprodutivo em uma população de capivaras sinantrópicas no campus da Universidade Federal de Viçosa – Viçosa, MG. 2013. 69 f. Tese (Doutorado em Medicina Veterinária) – Universidade Federal de Viçosa, Viçosa, 2013. Disponível em: <http://repositorio.ufv.br/handle/123456789/1457>. Acessado em 19 de novembro de 2018.
24-LABRUNA, M. ; PINTER, A. ; CASTRO, M. ; CASTAGNOLLI, K. ; GARCIA, M. ; SZABO, M. Some records on host questing behavior of Amblyomma cajennense (Acari: Ixodidae) larvae. Revista Brasileira de Parasitologia Veterinária, v. 11, n. 2, p. 91-93, 2002.
25-LABRUNA, M. B. ; KRAWCZAK, F. S. ; GERARDI, M. ; BINDER, L. C. ; BARBIERI, A. R. M. ; PAZ, G. F. ; RODRIGUES D. S. ; ARAÚJO R. N. ; BERNARDES, M. L. ; LEITE, R. C. Isolation of Rickettsia rickettsii from the tick Amblyomma sculptum from a Brazilian spotted fever-endemic area in the Pampulha Lake region, southeastern Brazil. Veterinary Parasitology: Regional Studies and Reports, v. 8, p. 82-85, 2017. doi: 10.1016/j.vprsr.2017.02.007.
26-POLO, G. ; LABRUNA, M. B. ; FERREIRA, F. Satellite hyperspectral imagery to support tick-borne infectious diseases surveillance. PLoS ONE, v. 10, n. 11, 2015. doi: 10.1371/journal.pone.0143736.
27-PEDROSA, F. ; SALERNO, R. ; PADILHA, F. V. B. ; GALETTI, M. Current distribution of invasive feral pigs in Brazil: economic impacts and ecological uncertainty. Natureza & Conservação, v. 13, n. 1, p. 84-87, 2015. doi: 10.1016/j.ncon.2015.04.005.
28-RAMOS, V. N. ; PIOVEZAN, U. ; FRANCO, A. H. A. ; OSAVA, C. F. ; HERRERA, H. M. ; SZABO, M. P. J. Feral pigs as hosts for Amblyomma sculptum (Acari: Ixodidae) populations in the Pantanal, Mato Grosso do Sul, Brazil. Experimental & Applied Acarology, v. 64, n. 3, p. 393-406, 2014. doi: 10.1007/s10493-014-9832-9.






